Razvoj OBDOBNE MIZE: od nastanka do danes
Periodična tabela je ena izmed najbolj ikonične ikone znanosti. Čeprav je bilo leto 2019 150. obletnica njegovega nastanka, še zdaleč ni končan dokument. V tej lekciji UČITELJA bomo videli, kaj razvoj periodnega sistema od njegovega nastanka do danes in kakšen napredek v poznavanju atomov in njihovih lastnosti je to omogočil.
Kazalo
- Kaj je periodni sistem?
- Prva periodna tabela: izvor
- Zgodovina periodnega sistema in razvoj
Kaj je periodni sistem?
The periodni sistem Periodični sistem elementov je znanstveni dokument, ki koncentrira več informacij v manj prostora in predstavlja eno najmočnejših ikon znanosti. Vsebuje dober del znanje o kemiji. V nobeni drugi znanstveni disciplini ni podobnega dokumenta.
Periodična tabela elementov je a sistem klasifikacije kemijskih elementov Začelo se je pred več kot 200 leti. Ta sistem klasifikacije je sčasoma naraščal in se spreminjal, ko je znanost napredovala in odkrivala nove. kemični elementi
. Vendar so bile vključene različne spremembe, ki so ohranile njegovo osnovno strukturo nedotaknjeno.Periodična tabela je tako poimenovana, ker izraža grafično način ponavljanja v rednih časovnih presledkih kemijske lastnosti. Je vrsta dvodimenzionalne predstavitve ali v sodobnejših predstavitvah tridimenzionalne.
V klasični periodni sistem (dvodimenzionalni) so kemični elementi razporejeni v skupine ali družine in so predstavljeni v trenutni periodni tabeli v navpičnih stolpcih. Urejena razporeditev teh skupin v stolpcih povzroči vrsto vrstic, ki jih imenujemo obdobja, kjer so elementi razvrščeni glede na njihovo atomsko težo. Periodična tabela je sestavljena iz sedmih obdobij, ki se razlikujejo po dolžini.

Prva periodna tabela: izvor.
Pred Mendelejevom so drugi znanstveniki razvili sisteme klasifikacije kemičnih elementov. Toda za razliko od periodnega sistema elementov so bili zgolj seznami znanih elementov; medtem ko ima periodni sistem posebnost, da gre za klasifikacijski sistem v dveh dimenzijah (vrstice in stolpci) ali tri dimenzije, v najsodobnejših različicah, kjer so kemični elementi razporejeni zaporedoma plasti.
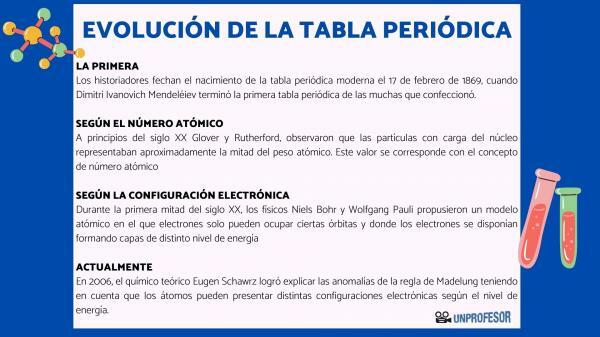
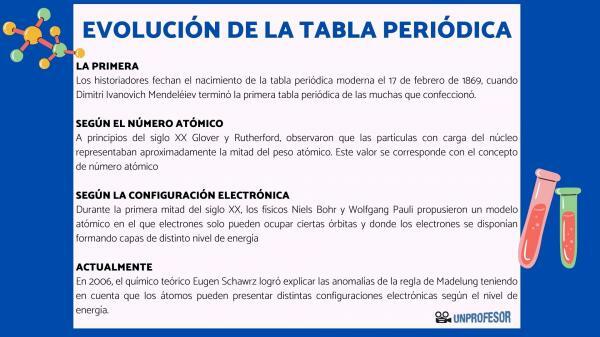
Iz tega razloga zgodovinarji datirajo rojstvo sodobnega periodnega sistema 17. februarja 1869, kdaj Dimitri Ivanovič Mendelejev dokončaj prva periodna tabela od mnogih, ki jih je ustvaril. Ta tabela je bila sestavljena iz 63 elementov, razporejenih po družinah in pustila prazne prostore za elemente, ki jih še niso odkril, a iz katerega je ugotovil njihovo atomsko težo (kot v primeru Galija, Germanija in Skandij)
Ključni podatki za odkritje periodnega sistema so bila predhodna znanja o atomska teža vsakega elementa.
Kaj sta atomska teža in atomsko število?
Ta številka predstavljala težo atoma in to je bila edina merljiva vrednost atomi. Vendar to ni šlo v nobenem primeru za neposredne meritve (ni merilnih naprav, ki bi omogočale tehtanje izoliranih atomov), ampak gre za sistem, ki je vzpostavil standard, v katerem je bila atomu vodika dana poljubna vrednost 1 in je bila glede na to izračunana vrednost atomske teže preostalih elementov Vzorec.
Prvi izračuni atomsko število elementov izvedel angleški kemik John Dalton, in je v prvi polovici 19. stoletja ustvaril veliko znanstveno razpravo. Vendar je bilo v drugi polovici 19. stoletja že doseženo izjemno soglasje o sistemu izračunavanja atomske teže elementov. Atomska teža je postala od Mendelejeva naprej, ključno merilo za pravilno urejanje elementov v periodnem sistemu.
Ko je Mendeleev znane elemente naročil v skladu z njihovimi naraščajoča atomska teža, opazili pojav ponavljajočih se lastnosti, ki so omogočale združevanje elementov v skupine ali družine elementov, ki so si bili podobni. Vendar se v nekaterih primerih urejanje elementov glede na njihovo atomsko težo ni odzvalo na podobnosti med opaženimi elementi in Mendeleev se je spremenil položaj 17 elementov v razporeditvi periodnega sistema kljub njihovi atomski teži, da bi jih lahko združili s tistimi elementi, s katerimi so predstavili analogije.
Te spremembe so jasno pokazale, da nekatere sprejete atomske uteži niso bile pravilne in so bile preračunane. Kljub popravkom atomskih uteži so še vedno obstajali elementi, ki jih je bilo treba postaviti v drugačne položaje, kot jih označujejo njihove atomske uteži.

Slika: BBC.com
Zgodovina periodnega sistema in razvoj.
Kljub nedvomnemu prispevku Mendelejeva periodni sistem elementov ni rezultat dela enega samega raziskovalca. Poleg Mendelejeva v drugi polovici devetnajstega stoletja in v dvajsetem stoletju mnogi Kemiki so še naprej preiskovali najboljši način za organiziranje informacij o kemičnih elementih znano. Še bolj glede na to, da je v tem času odkritje novih kemičnih elementov ali enostavnih snovi, zahvaljujoč spektrometriji (ki preučuje interakcije med atomi in elektromagnetnim sevanjem).
The razvrstitev elementov v periodnem sistemu je prvotno temeljil na začetnih izračunih atomske uteži elementov in razkrila analogije, ki so omogočile, da so bili elementi združeni v analogne družine. Kljub temu razloga za pojav teh periodičnih lastnosti ni bilo mogoče pojasniti. V celotnem 20. stoletju z odkritjem elektronske strukture je bil razumljen razlog za to periodičnost lastnosti elementov.
Atomska številka kot vrstni red
Na začetku 20. stoletja Glover in Rutherford, opazili, da so nabiti delci jedra predstavljali približno polovico atomske teže. Ta vrednost ustreza konceptu atomsko število ki je opredeljeno kot število protonov v atomskem jedru in ki sovpada s številom elektronov v nevtralnem atomu. Ta nova vrednost je upravičila spremembe položaja nekaterih elementov, ki so bile izvedene do takrat. Na primer sprememba položaja med telurijem in jodom.
Leta 1913 je Henry Moseley je z rentgensko spektrometrijo potrdil urejanje tabele v odvisnosti od atomskega števila. Razvrščanje po atomski številki velja še danes.
Hkrati so v 20. stoletju še naprej odkrivali nove kemijske elemente zahvaljujoč kvantni mehaniki in razvoju tehnike bombardiranje atomov z delci, iz druge polovice stoletja. S to novo tehniko je bilo mogoče ustvariti umetni elementi ki niso prisotni v naravi.
Čeprav je bil napredek dosežen pri pravilni razporeditvi elementov v periodnem sistemu, še vedno razlog za ponavljajoče se pojavljanje določenih lastnosti (lastnosti periodično). Razvoj kvantna mehanika (veja fizike, ki na mikroskopskem merilu preučuje vedenje svetlobe in atomov) iz leta 1920 je bila odločilna za razlago razloga za te lastnosti.
Elektronska konfiguracija kot razlaga periodičnih lastnosti
V prvi polovici 20. stoletja so fiziki Niels Bohr Y. Wolfgang Pauli predlagali so atomski model, v katerem lahko elektroni zasedajo samo določene orbite in kjer so elektroni razporejeni tako, da tvorijo plasti različnih ravni energije. Način, kako se elektroni porazdelijo po orbitalah v različnih lupinah ali ravneh energije, je znan kot elektronska konfiguracija.
Odkritje razporeditve elektronov v elektronskih konfiguracijah je bilo bistveno za razumevanje periodičnosti lastnosti. periodično, saj je bilo ugotovljeno, da so bile te lastnosti tesno povezane z najbolj oddaljeno elektronsko konfiguracijo atomov (plast Valencia).
Vrstni red, v katerem elektroni zapolnjujejo atomske orbitale, je leta 1930 določil fizik Erwin Madelung, ki je določil številčno pravilo za vrstni red polnjenja. To pravilo je znano kot Pravilo Madelung in to je empirično pravilo, ki ga ni mogoče razložiti s pomočjo kvantne mehanike.
Zaporedje polnjenja je za prve tri vrstice periodnega sistema preprosto, vendar v četrta vrstica, kjer se nahajajo prehodni elementi, je vrstni red polnjenja podvržen vrsti spremembe. Skupaj je 20 nepravilnih predmetov, ki temu pravilu ne sledijo.
Razvoj tabele se nadaljuje danes
Leta 2006 teoretični kemik Eugen Schawrz Uspelo mu je razložiti nepravilnosti Madelungovega pravila ob upoštevanju, da imajo lahko atomi različne elektronske konfiguracije, odvisno od ravni energije. Pri izračunu povprečij so elektronske konfiguracije večine elementov v skladu z Madelungovim pravilom.
Periodična tabela je še naprej predmet razprav v 21. stoletju, čeprav o ureditvi ali elektronski konfiguraciji elementov, še vedno velja razložiti ta vrstni red in opažene nepravilnosti v elektronskih konfiguracijah s pomočjo teorija.
Če želite prebrati več podobnih člankov Razvoj periodnega sistema - povzetek, priporočamo, da vnesete našo kategorijo Atom.
Bibliografija
Različni avtorji. (2019)Posebno: periodni sistem. Raziskave in znanost. Barcelona: Scientific Press S.A.



