VSE lastnosti ATOMA

Slika: SlideShare
Čeprav jih ne moremo videti s prostim očesom, atomi so del vse snovi našega planeta. Vsa snov je sestavljena iz atomov, ki se združijo v kemične elemente, molekule, spojine itd. Atom je definiran kot najmanjša osnovna enota snovi, ki ima lastnosti kemičnega elementa. Vsak kemični element je opredeljen z vrsto atoma, iz katerega je sestavljen, zato je zadnje vprašanje: kakšne lastnosti ima atom? V tej lekciji UČITELJA bomo pregledali lastnosti atoma ki naredijo vsak atom značilen kemični element.
Kazalo
- Kaj je atom?
- Atomsko število, masno število in izotopi
- Gostota, še ena od lastnosti atoma
- Jonski radij in polmer Vanderwalla
- Ionizacijska energija
Kaj je atom?
Preden začnemo analizirati lastnosti atoma, je pomembno, da bolje vemo, za kaj gre. The atom je enota, ki jo tvorijo trije subatomski delci: protoni, nevtroni in elektroni. Ti so organizirani v jedru in skorji.
- The jedro Izmišljeno je protoni Y. nevtroni, ki je v središču atoma in je odgovoren za večino teže atoma; protoni so pozitivno nabiti, nevtroni pa nevtralni, zato je jedro pozitivno nabito.
- The Korteks Oblikuje ga elektroni, ki so majhni, negativno nabiti delci, ki se vrtijo okoli jedra, ki tvori orbite (kot pri planetih), vendar ne da bi kdaj padli v jedro atoma. Korteks atoma je odgovoren za interakcijo s skorjo drugih atomov, saj se nahaja na zunanji strani atomov.
Različni atomi so sestavljeni iz protonov, nevtronov in elektronov, enakih v vseh kemičnih elementih. Torej, zakaj obstajajo različni kemični elementi? Število protonov, nevtronov in elektronov iz katerega so sestavljeni atomi vsakega elementa, je drugačen, zaradi česar ima vsak element drugačen Lastnosti ali drugih.

Slika: SlideShare
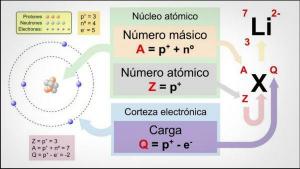
Atomsko število, masno število in izotopi.
Prve tri značilnosti so povezane neposredno s številom delcev, ki sestavljajo atom vsakega elementa.
The atomska številka (Z) označuje število protonov, ki sestavljajo jedro atoma. Tako bodo imeli na primer vsi atomi železa v svojem jedru 26 protonov. Poleg tega, če nam ne povedo drugače, so kemični elementi v nevtralnem stanju, to je pozitivni (protoni) in negativni (elektroni) naboj sta enaka, zato jih bodo vsi imeli tudi 26 elektroni.
The masno število ali atomska teža (A) označuje skupno število protonov in nevtronov, ki sestavljajo jedro atoma. Kot smo že omenili, je teža elektronov v primerjavi s težo elektronov praktično zanemarljiva. protoni in nevtroni, zato masno število posredno označuje težo zadevnega atoma. Če nadaljujemo s primerom železa, če se obrnete na periodni sistem elementov, boste videli, da teža atoma tega elementa je 55,85, kar pomeni, da bodo to imeli vsi atomi tega elementa utež.
Končno, izotopi kemičnega elementa so različice istega atoma (torej imajo enako atomsko število), vendar različno masno število, to je različno število nevtronov. Večina kemičnih elementov ima več kot en naravni izotop, element z največjo količino stabilnih izotopov je kositer (Sn), ki ima 10 različnih naravnih izotopov.

Slika: ConceptDefinition.de
Gostota, še ena od lastnosti atoma.
The gostoto atoma je število masnih enot (u.m.a) elementa, ki so prisotne v določeni prostornini prostora. Gostota katere koli snovi je simbolizirana z grško črko "Ro" (napisano r) in njegove enote po mednarodnem sistemu enot (SI) so kilogrami na kubični meter (kg / m3). Pri tako majhnih kemičnih elementih je gram na kubični centimeter (g / cm3).
Da bi izračunajte gostoto atoma (atomska gostota), bi morali upoštevati maso atoma in njegovo prostornino. Medtem ko je večina mase atoma v jedru istega, mora prostornina storiti kako velik je atom, zato bo imelo vlogo število elektronskih orbital pomembno. Ob upoštevanju teh lastnosti in njihove tendence v periodičnem sistemu lahko opazimo, da gostota narašča, ko se povečujemo v skupini, in tudi narašča, ko se približujemo osrednjemu delu od periodni sistem.

Slika: YouTube
Jonski radij in polmer Vanderwalla.
The ionski polmer je polmer, ki ga ima ion elementa v stanju ionskega kristala. V tem stanju so ioni tako blizu, da so najbolj oddaljene elektronske orbitale v stiku med seboj.
Po drugi strani pa polmer vanderwallov To je razdalja, na kateri sta dva atoma ločena zaradi odbijanja negativnih nabojev, ki obstajajo med elektroni vsakega od atomov. Polmer Vanderwallov bi bil polmer namišljene trdne krogle, ki se uporablja za modeliranje atoma, zato se v vsakdanji praksi ne uporablja veliko.
Za razliko od tega, kar se dogaja z gostoto ali maso, sta ti dve lastnosti tesno povezani s prostornino atoma, to pomeni, da imajo več opraviti s številom elektronov v njem kot z jedro.

Slika: SlidePlayer
Ionizacijska energija.
Na koncu je še ena od lastnosti atoma ionizacijska energija, lastnost, ki nam pove, kako energijo potrebujemo za ločevanje elektrona v osnovnem stanju (razen aniona ali kationa) atoma elementa v plinastem stanju, lahko pa bi ga opredelili tudi kot silo, s katero se elektron veže z drugimi molekul. Ta lastnost je zelo zanimiva, saj nam omogoča približno predstavo o sposobnost reagiranja atoma določenega kemičnega elementa. Energija ionizacije je večja, ko odstranimo elektrone, zato za element obstaja energija prva ionizacija, druga ionizacijska energija, in tako naprej in postajajo vedno večji.
Tako kot v prejšnjem primeru je tudi ta lastnost tesno povezana s številom orbital v zadevni element, ker manj kot ima orbital, več bo stalo odstranjevanje elektronov iz atoma določeno.

Slika: SlidePlayer
Če želite prebrati več podobnih člankov Lastnosti atoma, priporočamo, da vnesete našo kategorijo Atom.