Razlika med močnimi in šibkimi kislinami in bazami (s primeri)
Razvrstitev kislin in baz v kemiji je odvisna od ionizacijske sile teh snovi v vodnem mediju. A) Da:
- a kislina in baza sta močni ko so popolnoma ionizirani, torej se v procesu ionizacije popolnoma spremenijo v katione ali pozitivne ione in v anione ali negativne ione.
- Po drugi strani, kislina in baza sta šibki ko so delno ionizirani v vodi, torej v raztopini, bo delež kationov, še en delež anionov in še en delež neločljivih molekul.
| Močne kisline in baze | Šibke kisline in baze | |
|---|---|---|
| Definicija | Snovi, ki se v raztopini popolnoma ionizirajo. | Snovi, ki se delno ionizirajo v raztopini. |
| Ionizacija | Dokončano | Delno |
| Elementi v vodni raztopini | Kationi in anioni v isti koncentraciji. | Kationi, anioni in molekule v različnih razmerjih. |
| Ionizacijska konstanta | Povišana | Malo |
| Primeri |
|
|
Močne kisline in baze
A kislina ali baza sta močni, ko se v vodnem mediju popolnoma ločitaZ drugimi besedami, postopek ionizacije je končan in raztopina bo vsebovala enako koncentracijo anionov in kationov.
Kako ionizirate kislino in močno bazo?
Močna kislina, kot je klorovodikova kislina HCl, se ionizira na naslednje načine:
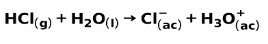
Močna baza, kot je natrijev hidroksid NaOH, ionizira na naslednje načine:
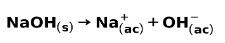
Primeri močnih kislin in njihove formule
| Močne kisline | Formula |
|---|---|
| Klorovodikova kislina | HCl |
| Žveplova kislina | H2SW4 |
| Dušikova kislina | HNO3 |
| Bromovodikova kislina | HBr |
| Perklorova kislina | HClO4 |
| Kromova kislina | H2CrO4 |
| Tetrafluroborna kislina | HBF4 |
Primeri močnih osnov in njihovih formul
| Močna podlaga | Formula |
|---|---|
| Natrijev hidroksid | NaOH |
| Litijev hidroksid | LiOH |
| Kalijev hidroksid | KOH |
| Rubidijev hidroksid | RbOH |
| Cezijev hidroksid | CsOH |
| Kalcijev hidroksid | Ca (OH)2 |
| Barijev hidroksid | Ba (OH)2 |
| Stroncijev hidroksid | Sr (OH)2 |
| Aluminijev hidroksid | Al (OH)3 |
Morda vas zanima več primeri kislin in baz.
Šibke kisline in baze
A Kislina ali baza je šibka, če je delno ionizirana v vodni raztopini, to pomeni, da so v raztopini ioni in neionizirane molekule.
Kako ionizirate kislino in šibko bazo?
Šibka kislina, na primer ocetna kislina CH3COOH, se ionizira na naslednji način:
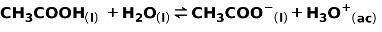
Ravnotežje te reakcije izrazimo s puščicama v nasprotnih smereh.
Ko šibka kislina disociira ali ionizira, se vzpostavi ravnotežje med vrstami, prisotnimi v raztopini; to lahko izrazimo z a ionizacijska konstantakislo:
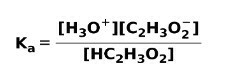
Ionizacijska konstanta ni nič drugega kot razmerje med množenjem koncentracije produktov nad množenjem koncentracije reaktantov.
Šibka baza, kot je NH amoniak3, se ionizira na naslednji način:
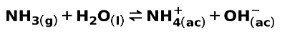
Ko se šibka baza disociira ali ionizira, se vzpostavi ravnovesje med vrstami, prisotnimi v raztopini; to lahko izrazimo z a osnovna ionizacijska konstanta:
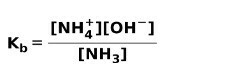
Morda vas zanima, kakšna je razlika med Kisline in baze.
Primeri šibkih kislin s formulo in kislinsko ionizacijsko konstanto Kdo
| Šibka kislina | Formula | Ionizacijska konstanta |
|---|---|---|
| Mravljinčna kislina | H2CO2 | 1,77 x 10-4 |
| Ocetna kislina | H3CCOH | 1,75 x 10-5 |
| Cijanovodikova kislina | HOCN | 3,30 x 10-4 |
| Vodikov cianid | HCN | 6,20 x 10-10 |
| Klorovodikova kislina | HOCl | 3,50 x 10-8 |
| Dušikova kislina | HNO2 | 4,00 x 10-4 |
| Mlečna kislina | HC3H5ALI3 | 1,40 x 10-4 |
| Ogljikova kislina | H2CO3 |
4,30 x 10-7 5,60 x 10-11 |
| Borova kislina | H3BO3 |
5,80 x 10-10 1,80 x 10-13 3,00 x 10-14 |
Primeri šibkih baz z njihovo formulo in osnovno ionizacijsko konstanto Kb
| Šibka osnova | Formula | Ionizacijska konstanta |
|---|---|---|
| Amoniak | NH3 | 1,75 x 10-5 |
| Metilamin | CH3NH2 | 4,38 x 10-4 |
| Etilamin | C2H5NH2 | 5,60 x 10-4 |
| Anilin | C6H5NH2 | 3,80 x 10-10 |
| Piridin | C5H5N | 1,70 x 10-9 |
| Benzilamin | C7H9N | 2,20 x 10-5 |
| Natrijev bikarbonat | NaHCO | 2,00 x 10-4 |
Morda vas zanima več o tem Značilnosti kislin in baz