Kakšne so VALENCE DUŠIKA

Dušik je zelo pomemben kemični element v našem življenju, Tako na dobro kot na slabše. Je glavni plin v ozračju, prisoten je v tleh in je zelo pomembna makromolekula za večino živih bitij. Je tudi del spojin velikega industrijskega pomena, kot so amoniak, pogonska goriva ali eksplozivi.
Zgodi se, da se njegova valenca in oksidacijsko stanje razlikujeta glede na spojino. V tej lekciji UČITELJA bomo govorili o kakšne so valence dušika. Če vas zanima ta kemični element, vam bo ta članek všeč!
Indeks
- Kaj je dušik in lastnosti
- Kakšne so valence dušika?
- Nomenklatura dušikovih spojin
- Pomembne dušikove spojine
- Učinki dušika na zdravje
- Učinki dušika na okolje
Kaj je dušik in lastnosti.
Dušik je kemični element s simbolom N. z atomsko številko 7, atomsko težo 14,0067 in najdemo v plinastem stanju v normalnih pogojih. Molekularni dušik predstavlja 78 % prostornine v suhem zraku in je zato glavni plin, prisoten v ozračju.
Ta visoka koncentracija dušika v ozračju je posledica električnega delovanja v atmosferi, fiksacije atmosferskega dušika z delovanje bakterij, kemično delovanje v industriji in sproščanje dušika z razgradnjo organske snovi ali z zgorevanje. V kombiniranem stanju, ki tvori spojine, se dušik nahaja v različnih stanjih.
Je element velikega pomena za živa bitja, saj Je del vseh beljakovin tako rastlinske kot živalske ter številne druge organske spojine. Dušik zaradi svoje sposobnosti tvori močne vezi z drugimi atomi, kot so dušik in drugi tvorijo trojne veziZato imajo dušikove spojine veliko količino energije.
Dušik je sestavljen iz dva izotopa:
- N14 (zelo večina)
- N15 in različni radioaktivni izotopi, ki nastajajo med jedrskimi reakcijami.
Je element velikega zanimanja v kemični industriji in spojinah, ki se uporabljajo v kmetijstvu. Uporablja se tudi v žarnicah z žarilno nitko in kadar je potrebna relativno inertna atmosfera.
Dušik v svoji elementarni obliki je pri običajnih temperaturah rahlo reaktiven z najpogostejšimi snovmi, medtem ko je pri povišanih pri temperaturah reagira s številnimi snovmi, kot so titan, aluminij, silicij, bor, berilij, kalcij, litij ali krom, s kisikom (O2) reagira na tvorijo okside, kot je dušikov oksid (NO), in z vodikom pri visokih temperaturah in tlaku tvorijo zelo pomembno industrijsko spojino, kot je npr. amoniak.
Vir slike: Monographs.com
Kakšne so valence dušika?
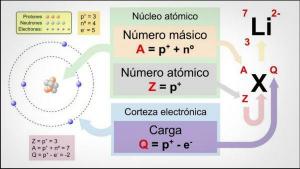
The valence kemičnega elementa je on številko od elektronov kaj manjkajo ali kaj naj dajo da izpolnite svojo zadnjo elektronsko raven.
The atomi ponavadi imajo 7 nivojev ali slojev kjer se nahajajo elektroni, pri čemer je 1 najbolj notranji in 7 najbolj zunanji. Po drugi strani pa obstajajo različne podravni, imenovane s, p, d in f. V atomu elektroni napolnijo različne ravni glede na svojo energijo, najprej napolnijo nižje energijske nivoje in se nato premaknejo na višjo raven.
Na najbolj oddaljeni nivo atoma imenuje se tudi kot valenčna lupina in elektroni, ki se nahajajo v tej lupini, se imenujejo valenčnih elektronov. Ti elektroni so odgovorni za nastanek vezi in možne kemične reakcije. z drugimi atomi, torej so elektroni, ki so odgovorni za fizikalne in kemijske lastnosti a element.
Različni načini združevanja dušika mu bodo dali valenco (znano tudi kot oksidacijsko stanje). Dušik ni sposoben razširiti svoje valenčne lupine, kot to počnejo drugi elementi v njegovi skupini. Njegove možne valence so -3, +3 in +5. Valenčno stanje dušika se razlikuje glede na spojino, katere del je. Tudi drugi elementi iz družine dušika imajo ta oksidacijska stanja in so fosfor (P), antimon (Sb), bizmut (Bi), moskovij (Mc) in arzen (As).
Nastajanje kemičnih spojin z dušikom lahko razložimo po teoriji valenčne vezi, glede na elektronsko konfiguracijo vsakega oksidacijskega stanja dušika. Za pojasnitev se upošteva število elektronov v njegovi valenčni lupini in koliko jih manjka, da bi dosegli elektronsko konfiguracijo žlahtnega plina.

Nomenklatura dušikovih spojin.
Dušikove spojine so kemično kompleksne in tradicionalna nomenklatura ni bila dovolj, da bi jih zlahka poimenovali in identificirali, torej ki jih je ustvarila Mednarodna zveza za čisto in uporabno kemijo (IUPAC) (tudi zaradi drugih dejavnikov) a sistematično nomenklaturo v katerih so spojine poimenovane glede na število atomov, ki jih tvorijo.
Ta nomenklatura je še posebej primerna za poimenovanje dušikovih oksidov. Tako se dušikov oksid imenuje dušikov monoksid in dušikov oksid (NO), dinitrogen monoksid (N2O).
Poleg te nomenklature je leta 1919 nemški kemik Alfred Stock razvil metodo, v kateri so bile spojine poimenovane odvisno od oksidacijskega stanja, predstavljeno z rimskimi številkami in v oklepajih. Na ta način bi dušikov oksid imenovali dušikov oksid (II) in dušikov oksid, dušikov oksid (I).

Slika: Youtube
Pomembne dušikove spojine.
Dušik se zaradi velikega števila možnih oksidacijskih stanj lahko veže na različne elemente in tvori veliko število spojin. V primeru molekularnega dušika je njegova valenca po definiciji 0.
Eno najpogostejših oksidacijskih stanj je -3. V tem oksidacijskem stanju dušik tvori spojine, kot so amoniak (NH3), amonijev ion (NH4-), nitrili (C≡N), imini (C=N-R) ali amini (R3N). Ko je dušik v oksidacijskem stanju -2, je v njegovi valenčni lupini ostalo 7 elektronov. Neparno število elektronov v njegovi valenčni lupini olajša tvorbo premostitvenih vezi med dvema atomoma dušika. V tem stanju dušik tvori hidrazone (C=N-N-R2) in hedrazine (R2-N-N-R2). V oksidacijskem stanju -1 ostane v valenčni lupini 6 elektronov in nastanejo spojine, kot so hidroksilamin (R2NOH) in azo spojine (RN=NR).
Ko dušik doseže pozitivna oksidacijska stanja, Dušik se veže na atome kisika in tvori okside, oksikisline ali oksisoli. V oksidacijskem stanju +1 ostane dušik v svoji valenčni lupini 4 elektroni. Tako imamo primere, kot so dušikov oksid (N2O), popularno znan kot smejalni plin, in dušikove spojine (R=NO). V stanju +2 imamo dušikov oksid ali dušikov oksid (NO), ki je brezbarven plin, ki nastane med reakcijo kovin z razredčeno dušikovo kislino. Ta spojina ima zelo nestabilen prosti radikal, ki lahko reagira s kisikom in tvori pomembno onesnaževalo ozračja, kot je dušikov dioksid (NO2).
V stanju +3 se spojine, kot je nitrit, tvorijo v bazični raztopini (NO2–) ali dušikova kislina v raztopini kisline (HNO2). Oba sta oksidanta, ki lahko povzročita nastanek dušikovega oksida (NO) ali pa sta redukcijska sredstva za tvorbo nitratnega iona. Druge spojine sta dušikov trioksid (N2O3) in nitro skupina (R-NO2). V stanju +4 imamo dušikov dioksid (NO2) ali dušikov dioksid. To je rjavo obarvan plin, ki nastane z reakcijo številnih kovin s koncentrirano dušikovo kislino, da nastane dušikov tetroksid (N2O4). Pri +5 lahko najdemo nitrate ali dušikovo kislino, ki so oksidanti v kislinskih raztopinah.
končno, Obstajajo spojine, v katerih je dušik v različnih oksidacijskih stanjih.. To so spojine, kot sta nitrosilazid ali dušikov trioksid.

Slika: Ambientum
Učinki dušika na zdravje.
Molekularni dušik je glavna plinasta sestavina atmosferskega plina. V vodi in zemlji ga najdemo v obliki nitratov in nitritov. Vse te spojine se med seboj povezujejo v ciklu dušika.
Človeško delovanje je spremenilo koncentracije nitratov in nitritov na kopnem, predvsem z vnosom gnojila z nitrati na tla. Poleg tega se koncentracija nitratov in nitritov v tleh in vodi poveča zaradi dušika, ki ga industrije oddajajo skozi dušikov cikel. To bi lahko povzročilo tudi povečano vsebnost dušika v pitni vodi.
The učinki nitratov in nitritov na zdravje ljudi lahko so:
- Nitrati negativno vplivajo na delovanje ščitnice
- Nitrati zmanjšajo shranjevanje vitamina A
- Tako nitrati kot nitriti proizvajajo nitrozamine, ki so pogost vzrok raka
- Nitrit reagira s hemoglobinom, kar povzroči zmanjšanje sposobnosti krvi za prenašanje kisika.
- Dušikov oksid (NO) je temeljni glasnik v človeškem telesu, ki povzroča sprostitev mišice, koristi za srčno-žilni sistem ali izvajajo signalne učinke na celice imunski sistem. Ti učinki so že izkoriščeni v številnih medicinskih aplikacijah, kot so zdravila proti srčnim napadom ali viagra.
Učinki dušika na okolje.
Dodajanje nitratov in nitritov gnojilom povzroči povečanje njihove koncentracije v okolju, kot tudi različne industrijske procese. Mnoge od teh spojin lahko pobegnejo v ozračje in reagirajo s kisikom, kar povzroči onesnaževanje atmosfere, ki spodbuja povečanje učinka tople grede.
Nitrati in nitriti pa povzročajo tudi škodljive učinke v sladki vodi in v morskem okolju, negativno vpliva na ta ekosistem in vrsto ki ga naseljujejo. Prav tako se koncentracije teh dušikovih spojin v pitni vodi drastično povečujejo, kar negativno vpliva na zdravje ljudi.
Če želite prebrati več člankov, podobnih Kakšne so valence dušika, priporočamo, da vnesete našo kategorijo atom.
Bibliografija
- Mayz-Figueroa, J. (2004). Biološka fiksacija dušika. Kmetijski znanstveni časopis UDO, 4(1), 1-20.
- Celaya-Michel, H., & Castellanos-Villegas, A. IN. (2011). Mineralizacija dušika v tleh sušnih in polsušnih območij. Terra Latinoamericana, 29(3), 343-356.
- Cárdenas-Navarro, R., Sánchez-Yáñez, J. M., Farías-Rodríguez, R., & Peña-Cabriales, J. J. (2004). Vnos dušika v kmetijstvo. Chapingo Magazine Horticulture Series, 10(2), 173-178.