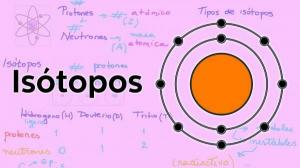
Главне КАРАКТЕРИСТИКЕ ИЗОТОПА

Слика: Планете
Сва материја која чини нашу планету састоји се од атома. Али сви атоми нису исти, атоми различитих елемената имају различит број протона, неутрона и електрона. Понекад и број ових субатомске честице нису исте, нису уравнотежени, а врсте као што су изотопи. Изотопи су атоми истог елемента (на пример, водоник), али који немају исти број неутрона. Ова „неравнотежа“ узрокује карактеристике изотопа истог елемента нису једнаки. У овој лекцији од НАСТАВНИКА детаљно ћемо размотрити све ове карактеристике. Почели смо!
Индекс
- Шта је изотоп?
- Атомске карактеристике изотопа
- Занимљива примена изотопа: изотопско обележавање
- Карактеристике изотопа истог елемента
Шта је изотоп?
Пре него што разговарамо о карактеристикама изотопа, важно је боље разумети од чега се ово састоји. субатомска честица. Могли бисмо рећи који су то изотопи су "подгрупе" атома: Су атома истог елемента али који се разликују у одређеним стварима.
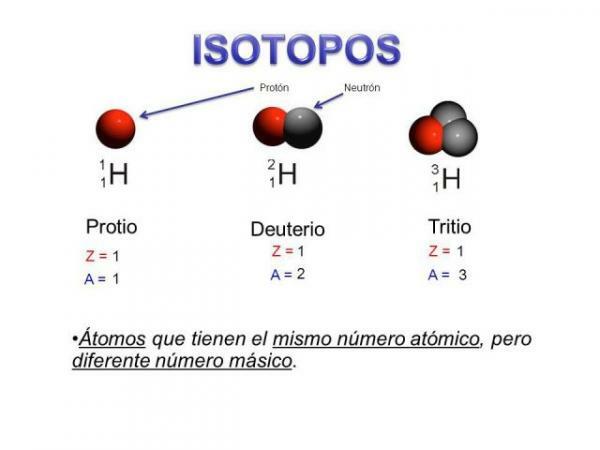
Изотопи су два атома са истим бројем протона
(исти атомски број), али различит број неутрона (различита атомска маса). Изотопи истог елемента обично се именују именом елемента праћеном његовом атомском масом. Познато је ил угљеник четрнаест (Ц14), који се користи за одређивање старости фосила, али угљеник има и друге изотопе као што су угљеник 12 и угљеник 13, који су стабилнији од осталих изотопа угљеника као што су угљеник 8 или угљеник угљеник 22.У нашем случају, сви ови атоми су атоми угљеника, тако да имају атомски број 6 (З = 6), али угљеник 12 („Нормални“ угљеник) има атомску тежину 12 насупрот атомској тежини 14 угљеника 14 или атомској тежини 8 угљеника Ц8.
Ове разлике између различитих изотопа могу проузроковати атоме да имају различите карактеристике, понашање са атомима других елемената, полувреме итд.
Слика: Ваши задаци
Атомске карактеристике изотопа.
- Прва карактеристика изотопа на атомском нивоу је да су сви изотопи атоми истог елемента.
- Ова главна карактеристика води нас до друге карактеристике: сви изотопи истог елемента имају исти атомски број, односно исти број протона.
- Сви изотопи елемента имају исти број протона.
- Изотопи истог елемента имају различит број неутрона, тј. различит масени број или атомска маса.

Слика: ЕХУ
Занимљива примена изотопа: изотопско обележавање.
Означавање изотопа је техника која користи две веома важне карактеристике изотопа: да сви изотопи реагују на исти начин у хемијске реакције и да неки од њих имају радиоактивност.
Током хемијске реакције, две или више супстанци, звани реагенси, они комбинују своје атоме да би створили друге различите супстанце које су резултат различитих комбинација, такозване производе. Тхе изотопско обележавање је техника помоћу које у реакцију можемо увести радиоактивни изотоп реагенса, тако да Ово ће реаговати на нормалан начин и можемо га лоцирати у било ком тренутку захваљујући радиоактивности која емитовати.
Остале варијанте ове технике омогућавају нам да идентификујемо различите изотопе реагенса масена спектрометрија или инфрацрвена спектроскопија.

Слика: Слидеплаиер
Карактеристике изотопа истог елемента.
Као последица атомских карактеристика из претходног одељка, изотопи истог елемента могу имати и друге врсте карактеристика, које ћемо описати у наставку.
- Изотопи истог елемента имају различита маса. Физичка својства као што су густина, који ће бити различити за различите изотопе истог елемента.
- Сигуран хемијска својства они зависе од врсте елемента који он јесте и зато се неће разликовати за различите изотопе елемента. Пример је растворљивост, шта ће бити константан за све изотопе елемента.
- С њиховом једнакошћу у хемијским својствима уско је повезана следећа карактеристика изотопа: изотопи истог елемента реагују на исти начин у хемијским реакцијама. То значи да ако атом угљеника 12 (најчешћи или „нормални“ атом) реагује са два атома кисеоника Да бисмо формирали молекул угљен-диоксида, знамо да су и остали изотопи угљеника они ће. Ово је врло важно својство за многе практичне примене изотопа и радиоизотопа.
- Изотопи елемента могу бити од природног или вештачког порекла. Ако се изотоп о коме је реч може наћи у природи, а да при његовом стварању није интервенисала рука човека, суочавамо се са изотопом природно, али ако је створен у нуклеарним реакторима, акцелераторима честица или генераторима радиоизотопа, кажемо да је вештачки. исти елемент може имати природне и вештачке изотопе.
- Изотопи могу бити радиоактивни или нерадиоактивни. Радиоактивни изотопи су они у којима постоји вишак енергије, коју атом настоји елиминисати да би из нестабилног стања прешао у стање стабилности више.
- У вези са претходним карактеристикама можемо рећи да изотопи радиоактивни они имају променљиво време живота. Животни век је време потребно да се изотоп распадне, односно да престане да има вишак енергије због које је нестабилан. Постоје радиоактивни изотопи који су врло нестабилни и имају животно време од секунди, док другима требају сати или чак године да се распадну и постану стабилнији изотопи. Нормално вештачки створени атоми имају много краћи животни век или време распадања од природних.
Ако желите да прочитате још чланака сличних Карактеристике изотопа, препоручујемо вам да уђете у нашу категорију Атом.
Библиографија
- Брицено В, Г. (с.ф) Изотопи.
- Белмонте, А. (15. маја 2019). Особине атома.
- Википедија (22. октобра 2019). Изотоп.