Utvecklingen av den PERIODISKA TABELLEN: från dess skapelse till idag
Det periodiska systemet är ett av mest ikoniska ikoner av vetenskapen. Även om 2019 var 150-årsjubileet för dess skapande, är det inte på något sätt ett färdigt dokument. I den här lektionen från en LÄRARE kommer vi att se vad utvecklingen av det periodiska systemet från dess skapelse till idag och vilka framsteg inom kunskapen om atomer och deras egenskaper har gjort det möjligt.
Index
- Vad är det periodiska systemet?
- Första periodiska systemet: ursprunget
- Det periodiska systemets historia och evolution
Vad är det periodiska systemet?
De periodiska systemet Det periodiska elementsystemet är det vetenskapliga dokumentet som koncentrerar mer information på mindre utrymme och utgör en av de mest kraftfulla ikonerna för vetenskapen. Den innehåller en bra del av kunskap vi har om kemi. Det finns inget liknande dokument i någon annan vetenskaplig disciplin.
Elementens periodiska system är a klassificeringssystem för kemiska element
Det började för mer än 200 år sedan. Detta klassificeringssystem har vuxit och förändrats över tid, när vetenskapen utvecklades och nya upptäcktes. kemiska element. De olika modifieringarna har emellertid införlivats så att den grundläggande strukturen är intakt.Det periodiska systemet heter så därför uttrycker grafiskt hur de upprepar med jämna mellanrum vissa kemiska egenskaper. Det är en typ av tvådimensionell representation eller, i dess mer moderna representationer, tredimensionell.
I klassiskt periodiskt system (tvådimensionellt) de kemiska elementen är ordnade i grupper eller familjer och representeras i den aktuella periodiska tabellen i vertikala kolumner. Det ordnade arrangemanget av dessa grupper i kolumner ger upphov till en serie rader, som kallas perioder, där elementen ordnas efter deras atomvikt. Det periodiska systemet består av sju perioder som varierar i längd.

Första periodiska systemet: ursprunget.
Innan Mendeleev hade andra forskare utvecklat klassificeringssystem för kemiska element. Men till skillnad från elementens periodiska system var de det bara listor över kända element; medan det periodiska systemet har den egenskapen att det är ett klassificeringssystem i två dimensioner (rader eller kolumner) eller tre dimensioner, i de modernaste versionerna, där de kemiska elementen är ordnade i följd skikten.
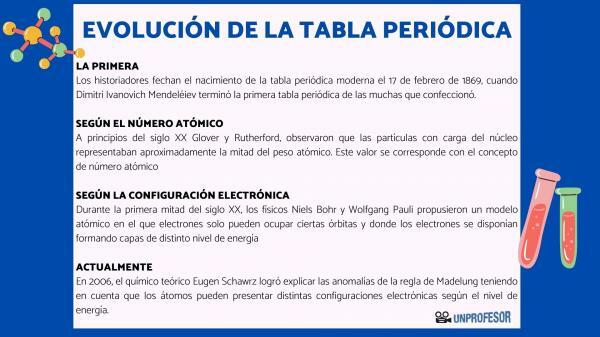
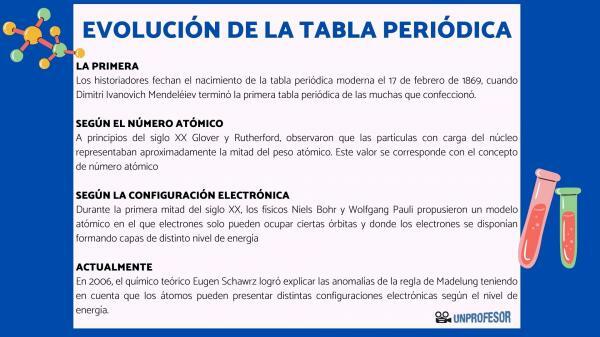
Av denna anledning daterar historiker födelsen av det moderna periodiska systemet 17 februari 1869, när Dimitri Ivanovich Mendeleev bli klar med första periodiska systemet av de många som han gjorde. Denna tabell bestod av 63 element ordnade i familjer och lämnade tomma utrymmen för element ännu inte upptäckt, men från vilken han hade dragit deras atomvikt (som i fallet med Gallium, Germanium och Skandium)
Nyckeldata för upptäckten av det periodiska systemet var tidigare kunskaper om atomvikt av varje element.
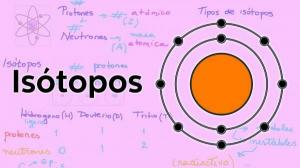
Vad är atomvikt och atomnummer?
Detta nummer representerade vikten av atomen och det var det enda mätbara värdet av atomer. Men det var inte i något fall direkta mätningar (det finns inga mätanordningar som tillåter vägning av isolerade atomer) utan de var ett system som etablerade en standard där ett godtyckligt värde av 1 gavs till väteatomen och värdet av atomvikten för de återstående elementen beräknades i förhållande till detta Mönster.
De första beräkningarna av atomnummer av elementen utfördes av den engelska kemisten John daltonoch genererade en stor vetenskaplig debatt under första hälften av 1800-talet. Men under andra hälften av 1800-talet fanns det redan en anmärkningsvärd enighet om systemet för beräkning av elementens atomvikt. Atomvikten blev från och med Mendeleev, ett nyckelkriterium för korrekt ordning av elementen inom det periodiska systemet.
När Mendeleev beställde de kända elementen enligt deras ökar atomviktenobserverade uppkomsten av återkommande egenskaper som gjorde att elementen kunde grupperas i grupper eller familjer av element som liknade varandra. I vissa fall svarade emellertid ordningen av elementen enligt deras atomvikt inte på likheterna mellan element som observerades och Mendeleev förändrades positionen för 17 element i arrangemanget av det periodiska systemet trots deras atomvikter, för att kunna gruppera dem med de element som de presenterade analogier med.
Dessa förändringar visade att vissa av de accepterade atomvikterna inte var korrekta och beräknades om. Trots korrigeringarna i atomvikterna fanns det fortfarande element som måste placeras i andra positioner än de som anges med deras atomvikter.

Bild: BBC.com
Det periodiska systemets historia och evolution.
Trots Mendeleevs otvivelaktiga bidrag är den periodiska tabellen över element inte resultatet av en enda forskares arbete. Förutom Mendeleev, under andra hälften av 1800-talet och under hela 1900-talet många Kemister fortsatte att undersöka det bästa sättet att organisera information om kemiska element känd. Ännu mer med tanke på att under denna tid upptäckten av nya kemiska element eller enkla ämnen, tack vare spektrometri (som studerar interaktioner mellan atomer och elektromagnetisk strålning).
De klassificering av element i det periodiska systemet baserades ursprungligen på begynnelseberäkningarna av atomvikter av elementen och avslöjade analogier som gjorde det möjligt att gruppera elementen i analoga familjer. Ändå kunde orsaken till utseendet på dessa periodiska egenskaper inte förklaras. Det var under 20-talet, med upptäckten av elektronisk struktur, när anledningen till denna periodicitet i elementens egenskaper förstods.
Atomtalet som en sorteringsordning
I början av 1900-talet Glover och Rutherfordobserverade att de laddade partiklarna i kärnan svarade för ungefär hälften av atomvikten. Detta värde motsvarar begreppet atomnummer som definieras som antalet protoner i atomkärnan och som sammanfaller med antalet elektroner i en neutral atom. Detta nya värde motiverade ändringarna i position för vissa element som hade genomförts fram till dess. Till exempel förändring av position mellan Tellurium och jod.
År 1913 Henry Moseley bekräftade ordningen av tabellen som en funktion av atomnummer genom röntgenspektrometri. Ordningen enligt atomnummer är fortfarande i kraft idag.
Samtidigt, under 1900-talet, fortsatte nya kemiska element att upptäckas tack vare kvantmekanik och utvecklingen av tekniken för bombardemang av atomer av partiklar, från andra hälften av seklet. Med denna nya teknik var det möjligt att skapa konstgjorda element som inte finns i naturen.
Även om framsteg hade gjorts i det korrekta arrangemanget av elementen inom det periodiska systemet, ändå orsaken till återkommande förekomst av vissa egenskaper (egenskaperna periodisk). Utvecklingen av kvantmekanik (gren av fysik som studerar beteendet hos ljus och atomer i mikroskopisk skala) från 1920 var avgörande för att förklara orsaken till dessa egenskaper.
Elektronisk konfiguration som en förklaring av periodiska egenskaper
Under första hälften av 1900-talet, fysiker Niels Bohr Y Wolfgang Pauli de föreslog en atommodell där elektroner bara kan uppta vissa banor och där elektronerna är ordnade och bildar lager med olika energinivåer. Det sätt på vilket elektronerna distribueras i orbitalerna i de olika skalen eller energinivåerna är känt som elektronisk konfiguration.
Upptäckten av arrangemanget av elektroner i elektronkonfigurationer var grundläggande för att förstå egenskaperna för periodicitet. periodiskt, eftersom det observerades att dessa egenskaper var nära besläktade med den yttersta elektroniska konfigurationen av atomerna (lager av Valencia).
Ordningen i vilken elektroner fyller atomorbitalerna fastställdes 1930 av fysikern Erwin Madelung som fastställde en numerisk regel för fyllningsordningen. Denna regel är känd som Madelung härskar och det är en empirisk regel som inte kunde förklaras med kvantmekanik.
Fyllningssekvensen är enkel för de tre första raderna i det periodiska systemet, men i fjärde raden, där övergångselementen är placerade, genomgår ordningen för fyllning en serie av förändringar. Det finns totalt 20 avvikande föremål som inte följer denna regel.
Tabellens utveckling fortsätter idag
År 2006, den teoretiska kemisten Eugen Schawrz Han lyckades förklara anomalierna i Madelungs regel med hänsyn till att atomer kan ha olika elektroniska konfigurationer beroende på energinivån. Vid beräkning av medelvärdet följer elektronkonfigurationerna för de flesta element Madelungs regel.
Det periodiska systemet är fortfarande en fråga om debatt under 2000-talet, även om arrangemanget eller den elektroniska konfigurationen av elementen är det fortfarande giltigt att förklara denna ordning och de avvikelser som observerats i de elektroniska konfigurationerna med hjälp av a teori.
Om du vill läsa fler artiklar som liknar Utvecklingen av det periodiska systemet - sammanfattningrekommenderar vi att du anger vår kategori av Atomen.
Bibliografi
Olika författare. (2019)Special: det periodiska systemet. Forskning och vetenskap. Barcelona: Scientific Press S.A.