การจำแนกประเภทโลหะจากตารางธาตุ

โลหะ คือ องค์ประกอบที่อุดมสมบูรณ์มากขึ้น บน ตารางธาตุ. มีลักษณะดังนี้: เป็นตัวนำความร้อนและไฟฟ้าที่ดี เป็นของแข็งที่อุณหภูมิห้อง (ด้วยwith ยกเว้นปรอทที่เป็นของเหลว) และมีความสามารถในการสะท้อนแสงจึงมีความมันวาว ลักษณะ
แต่ชุดองค์ประกอบที่ยอดเยี่ยมนี้ถูกนำเสนอโดยเรียงลำดับภายในตารางธาตุในกลุ่มหรือตระกูลต่างๆ ซึ่งสะท้อนถึงความเหมือนและความแตกต่าง ในบทเรียนนี้จากครู เราจะมาดูกันว่า การจำแนกประเภทของโลหะ และลักษณะและคุณสมบัติของกลุ่มต่าง ๆ ที่กำหนดไว้ในประเภทนี้คืออะไร
ดังที่เราได้กล่าวไปแล้ว โลหะเป็นองค์ประกอบหลักของ ตารางธาตุ. มีการกระจายใน สองหนุ่มใหญ่ ซึ่งรวมถึงประเภทย่อยต่างๆ ในแต่ละกรณีซึ่งจัดกลุ่มเป็นกลุ่มของช่วงต่างๆ ของตารางธาตุ
ด้านล่างเรานำเสนอโครงร่างสั้น ๆ ของการจัดหมวดหมู่นี้ ซึ่งเราจะพัฒนารายละเอียดเพิ่มเติมในหัวข้อต่อไปนี้
- 1. โลหะที่เป็นตัวแทน: บล็อก s ของตารางธาตุ
- 1.1. ครอบครัวของ โลหะอัลคาไล
- 1.2. ครอบครัวของ โลหะอัลคาไลน์เอิร์ ธ
- 2. โลหะทรานซิชัน: บล็อก d ของตารางธาตุ
- 3. โลหะทรานซิชันภายใน: บล็อก f ของตารางธาตุ
- 3.1. แลนทาไนด์: องค์ประกอบของช่วงที่ 6 ของตาราง
- 3.2. แอคติไนด์: องค์ประกอบของคาบที่ 7 ของตาราง
- 4. โลหะหลังการเปลี่ยนแปลง: p บล็อกของตารางธาตุ

รูปภาพ: Educamix
องค์ประกอบที่เป็นตัวแทนหรือองค์ประกอบหลักคือองค์ประกอบเหล่านั้นที่ อุดมสมบูรณ์มากขึ้นในธรรมชาติ ในบรรดาธาตุโลหะ ธาตุที่เป็นตัวแทนคือโลหะของ บล็อก sกล่าวคือธาตุอัลคาไลน์ (ตระกูล 1 ของตารางธาตุ) และธาตุอัลคาไลน์เอิร์ ธ (ตระกูล 2 ของตารางธาตุ)
ในสองกลุ่มนี้ เราพบองค์ประกอบที่มีปฏิกิริยาไวมาก โดยมีแนวโน้มสูงที่จะออกซิไดซ์ (สูญเสียอิเล็กตรอนของพวกมันจากเปลือกเวเลนซ์) และด้วยเหตุนี้ พวกมันจึงเป็นตัวรีดิวซ์ที่มีประสิทธิภาพขององค์ประกอบอื่นๆ โดยธรรมชาติจะพบในรูปของเกลือไอออนิกที่ละลายได้ดีในน้ำ ออกไซด์ หรือไฮดรอกไซด์ (เบสแก่)
โลหะอัลคาไล (กลุ่มที่ 1 ของตารางธาตุ)
- โลหะอัลคาไลเป็นตัวแทนของเปลือกโลก 5% โซเดียม (Na) และโพแทสเซียม (K) พวกเขามีความอุดมสมบูรณ์มากที่สุด
- พวกเขาเป็น องค์ประกอบที่เป็นประกาย ลักษณะสีเงิน ความหนาแน่นต่ำ โลหะอ่อน และมีปฏิกิริยาสูง เนื่องจากมีความไวต่อปฏิกิริยาสูง จึงไม่พบในสภาพบริสุทธิ์ในธรรมชาติ จุดเดือดหรือระเหยของโลหะอัลคาไลค่อนข้างต่ำและเป็นตัวนำความร้อนและไฟฟ้าที่ดี
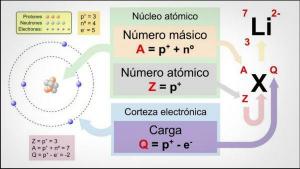
- จากมุมมองของโครงแบบอิเล็กทรอนิกส์ พวกมันเป็นองค์ประกอบที่นำเสนอa อิเล็กตรอนเดี่ยว ครอบครองวงโคจรของเปลือกเวเลนซ์ของมัน มีกำลังรวมเป็น 1 (วาเลนซ์) และเลขออกซิเดชัน +1 พวกเขามีแนวโน้มที่ดีที่จะสูญเสียอิเล็กตรอนจากเปลือกนอกสุดเพื่อสร้างไพเพอร์
- ในฐานะที่เป็นองค์ประกอบทางชีวภาพ โลหะอัลคาไลจะพัฒนา a บทบาทสำคัญในสิ่งมีชีวิต โดยเฉพาะโซเดียมและโพแทสเซียม ซึ่งมีบทบาทสำคัญในการส่งต่อเส้นประสาท และในกรณีของโพแทสเซียม จะควบคุมการทำงานของเอนไซม์
- โลหะเหล่านี้มี การใช้งานหลายอย่างในอุตสาหกรรม ตัวอย่างเช่น ลิเธียม (Li) ใช้ในการผลิตโลหะผสมอะลูมิเนียมที่มีความแข็งแรงสูง ในการผลิตเซรามิก หรือเป็นส่วนประกอบแบตเตอรี่ นอกจากนี้ยังมีการใช้ทางการแพทย์เนื่องจากเป็นส่วนประกอบของระบบประสาทและความบกพร่องของระบบประสาททำให้เกิดโรคทางจิตเวช
บันทึก: กลุ่มที่ 1 ของตารางธาตุยังรวมถึงไฮโดรเจนซึ่งไม่ใช่โลหะ
โลหะอัลคาไลน์เอิร์ ธ (กลุ่มที่ 2 ของตารางธาตุ):
- โลหะอัลคาไลน์เอิร์ ธ คิดเป็น 4% ขององค์ประกอบของเปลือกโลก มีมากเป็นพิเศษ แคลเซียม (Ca) และแมกนีเซียม (Mg)
- เช่นเดียวกับโลหะอัลคาไล โลหะเหล่านี้ พวกมันมีปฏิกิริยาตอบสนองมาก ดังนั้นจึงไม่พบในรูปแบบอิสระในธรรมชาติ
- แม้ว่าพวกมันจะมีลักษณะทางเคมีกายภาพคล้ายกับโลหะอัลคาไล แต่ก็มีแนวโน้มที่จะแข็งและมีปฏิกิริยาน้อยกว่าโลหะอัลคาไล มีความหนาแน่นต่ำ และความแข็งและจุดหลอมเหลวที่สูงกว่าโลหะอัลคาไล
- จากมุมมองของการกำหนดค่าอิเล็กตรอน พวกเขามีลักษณะโดย นำเสนอวงโคจรของเปลือกความจุที่เติม (นั่นคือครอบครองโดยอิเล็กตรอนคู่หนึ่ง) ดังนั้นจึงมีกำลังรวมเป็น 2 (วาเลนซ์) และเลขออกซิเดชันเท่ากับ +2 พวกมันทำปฏิกิริยากับฮาโลเจนได้ง่าย (กลุ่มที่ 17 ของตารางธาตุ) เพื่อสร้างเกลือไอออนิก
- บทบาทของคุณในฐานะ องค์ประกอบของสิ่งมีชีวิต มีความสำคัญอย่างยิ่งในกรณีของแคลเซียม (Ca) และแมกนีเซียม (Mg) แมกนีเซียมและแคลเซียมไอออนเป็นไอออนที่มีมากที่สุดในน้ำทะเลร่วมกับคลอไรด์ไอออน (Cl-).
- 99% ของแคลเซียมในร่างกายของเราพบได้ในโครงกระดูก แต่อยู่ในรูปไอออนิก มีบทบาทพื้นฐานในการส่งผ่านเส้นประสาท การทำงานของประสาทและกล้ามเนื้อ และการควบคุม เอนไซม์
- แมกนีเซียมในรูปไอออนิกทำหน้าที่ทางชีวภาพที่สำคัญในสิ่งมีชีวิต รวมทั้ง ที่โดดเด่นที่สุด บทบาทพื้นฐานในการสังเคราะห์แสงของพืชที่เป็นส่วนประกอบของ คลอโรฟิลล์
- การใช้โลหะอัลคาไลน์เอิร์ ธ ในอุตสาหกรรมนั้นมีความหลากหลาย ที่เกี่ยวข้องมากที่สุดคือการใช้แคลเซียมเป็นส่วนประกอบของปูนซีเมนต์ การใช้แมกนีเซียมในการดับไฟ ประดิษฐ์เป็นการเคลือบโครงสร้างเหล็กเพื่อป้องกันการเกิดออกซิเดชันหรือเป็นส่วนประกอบของโลหะผสมและเหล็กกล้า เบา.

รูปภาพ: Google Sites
ภายในการจำแนกประเภทของโลหะ เราต้องพูดถึงโลหะทรานสิชันหรือโลหะของ บล็อก d, เป็นกลุ่มโลหะที่มีมากที่สุดและจัดกลุ่มเป็น รวม 10 กลุ่มหรือครอบครัว ของตารางธาตุ
- โลหะทรานสิชันส่วนใหญ่มีลักษณะคล้ายคลึงกับโลหะที่เป็นตัวแทน: ดี are ตัวนำความร้อนและไฟฟ้าและสะท้อนแสง.
- พวกเขาแสดงความแปรปรวนอย่างมากในแง่ของความแข็งและจุดเดือดและจุดหลอมเหลว แต่โดยทั่วไปแล้วพวกเขาจะ แข็งและมีจุดหลอมเหลวและจุดเดือดสูงกว่าโลหะอัลคาไลและ ดินอัลคาไลน์
- จาก มุมมองทางเคมี มีลักษณะดังนี้: มีเลขพิกัดหลายตัว (วาเลนซ์) หรือสถานะออกซิเดชัน ซึ่งมักจะเป็นตัวเร่งปฏิกิริยาที่ดี (ความสามารถในการเพิ่มหรือลดอัตราการเกิดปฏิกิริยาเคมี) และสร้างสารประกอบที่มีสีและมีความสามารถในการ สร้างคอมเพล็กซ์การประสานงาน (สารประกอบเคมีที่มีไอออนโลหะอยู่ตรงกลางติดกับชุดของลิแกนด์ที่จัดเรียงไว้ที่ รอบ) ด้วยเหตุนี้ โลหะทรานสิชันจึงเกิดเป็นไอออนบวกที่มีประจุต่างกัน
- ความหนาแน่นมีความแปรปรวนสูง ในบล็อกธาตุนี้ ตั้งแต่สตรอนเทียมที่มีความหนาแน่นต่ำไปจนถึงออสเมียม (Os) ซึ่งเป็นธาตุที่มีความหนาแน่นสูงสุดในตารางธาตุ
- หากเราดูการกำหนดค่าทางอิเล็กทรอนิกส์ของโลหะทรานซิชัน d orbitals ที่เติมบางส่วน การเติม orbitals ในบล็อกของตารางธาตุนี้นำเสนอชุดของความผิดปกติซึ่ง สะท้อนให้เห็นในหลายเลขออกซิเดชันที่โลหะได้มาในบล็อกนี้ของตาราง เป็นระยะ
เหล็ก (เฟ) และไททาเนียม (Ti): โลหะทรานซิชันที่มีมากขึ้น
- ธาตุเหล็กมีมากที่สุด และคิดเป็นประมาณ 5% ของน้ำหนักของเปลือกโลก หายากในธรรมชาติในรูปแบบธาตุ ซึ่งปกติจะพบเป็นออกไซด์และคาร์บอเนต
- เหล็กบริสุทธิ์มีประโยชน์น้อย แต่โลหะผสมกับสารอื่นมีประโยชน์หลายอย่าง รูปแบบที่มีประโยชน์ของโลหะผสมเหล็กคือเหล็กดัด (เป็นโลหะผสมเหล็กที่มีปริมาณคาร์บอนต่ำและมีธาตุเหล็กสูง มีคุณสมบัติสามารถขึ้นรูปด้วยความร้อนแดงและแข็งตัวเมื่อเย็นตัวเร็ว) เหล็กหล่อ (ซึ่งเรียกอีกอย่างว่า ชื่อของเหล็กหล่อเทาหรือเหล็กหล่อ เป็นโลหะผสมของเหล็ก ซิลิกอน และคาร์บอนที่มีแมงกานีส ฟอสฟอรัส และ กำมะถัน; โดยที่คาร์บอนอยู่ในรูปของกราไฟต์) และเหล็กกล้า (โลหะผสมบริสุทธิ์ของเหล็กและคาร์บอน)
- โลหะทรานซิชันอื่นๆ ที่ใช้กันอย่างแพร่หลายในอุตสาหกรรม ได้แก่ ทองแดงและเงิน นอกจากนี้ โลหะทรานซิชันหลายชนิดยังถูกใช้ในอุตสาหกรรมเป็นตัวเร่งปฏิกิริยาสำหรับปฏิกิริยาเคมี
- ในระดับชีวภาพ ธาตุเหล็กในรูปไอออนิกมีบทบาทพื้นฐานใน การขนส่งออกซิเจน, เนื่องจากเป็นส่วนหนึ่งของศูนย์กลางการทำงานของเฮโมโกลบินและไมโอโกลบิน

รูปภาพ: เว็บไซต์ 100cia
โลหะทรานซิชันภายในหรือโลหะของ บล็อก fพวกเขาจะเรียกว่าแผ่นดินที่หายาก พวกเขาถูกจัดกลุ่มเป็นสองกลุ่มขององค์ประกอบ: แลนทาไนด์ และ แอคติไนด์. พวกมันคือองค์ประกอบโลหะที่พบอิเล็กตรอนครอบครองออร์บิทัล f องค์ประกอบของกลุ่มแลนทาไนด์ได้ครอบครองบางส่วน f ออร์บิทัลของระดับ 4 และแอคติไนด์ของระดับ 5
แลนทาไนด์หรือแลนทานอยด์
- เป็นองค์ประกอบ 15 ประการของการเปลี่ยนแปลงภายใน ที่เป็นส่วนหนึ่งของ ระยะเวลา 6 ของตารางธาตุ.
- องค์ประกอบกลุ่มนี้มีคุณสมบัติลักษณะเฉพาะร่วมกัน เกี่ยวกับ โลหะอ่อนและสีเงินวาว การนำความร้อนและไฟฟ้าค่อนข้างต่ำเมื่อเทียบกับโลหะอื่นๆ เป็นโลหะที่มีความหนาแน่นต่ำกว่าโลหะทรานซิชัน
- โดยธรรมชาติจะพบในสัดส่วนที่ต่ำ ประกอบเป็นชิ้นส่วนจำนวนมาก แร่ธาตุ. แลนทาไนด์มีความสามารถสูงในการทำให้เป็นแม่เหล็กหรือทำให้เป็นแม่เหล็ก และยังมีลักษณะเฉพาะด้วยการเรืองแสงของไอออนบวกของพวกมัน
- แลนทาไนด์มี การใช้งานหลายอย่างในอุตสาหกรรม ในการผลิตแม่เหล็กถาวรที่แข็งแรง แบตเตอรี่แบบชาร์จไฟได้ และการผลิตวัสดุตัวนำยิ่งยวด มีการใช้งานที่หลากหลายในด้านออปติก (การผลิตหลอดฟลูออเรสเซนต์และโคมไฟ จอภาพคริสตัลเหลว และเลเซอร์) พวกเขายังใช้เป็นตัวเร่งปฏิกิริยาสำหรับปฏิกิริยาเคมีหรือเป็นเม็ดสี
แอคติไนด์หรือแอกตินอยด์
- คือธาตุทั้ง 15 ที่ประกอบขึ้นเป็น ระยะเวลา 7 ของตารางธาตุ
- หลายคนถูกสังเคราะห์ขึ้นโดยไม่ได้ตั้งใจ แต่ก็พบได้ในธรรมชาติในสัดส่วนที่น้อยมาก
- พวกเขาแสดงพฤติกรรมคล้ายกับโลหะทรานสิชัน (บล็อก d) และแตกต่างจากแลนทาไนด์ เช่นเดียวกับโลหะหลายชนิด พวกมันมีลักษณะเป็นเงาสีเงิน
- ในกลุ่ม ความสำคัญของพวกเขาอยู่ที่ความจริงที่ว่าพวกเขาทั้งหมด ธาตุกัมมันตรังสี. นั่นคือองค์ประกอบเหล่านี้ซึ่งนิวเคลียสไม่เสถียรสลายตัว ปล่อยพลังงาน (พลังงานนิวเคลียร์) และก่อให้เกิดองค์ประกอบทางเคมีอื่นๆ ที่มีนิวเคลียสที่เสถียรกว่า ไอโซโทปของธาตุในกลุ่มนี้มีกัมมันตภาพรังสีและมีครึ่งชีวิตสั้น แอคติไนด์ที่มีมากที่สุดในธรรมชาติ ได้แก่ ยูเรเนียม (U) และทอเรียม (Th)

ภาพ: Slideshare