โครงสร้างและลักษณะของอะตอม

ภาพ: SlidePlayer
อะตอมเป็นส่วนหนึ่งของโลกของเรา สสารทั้งหมดประกอบด้วยอะตอม ดังนั้นจึงเป็นสิ่งสำคัญที่จะเข้าใจได้ดีขึ้นว่าประกอบด้วยอะไรและมีหน้าที่อะไร ในบทเรียนนี้จากครู เราจะบอกคุณว่า โครงสร้างของอะตอมและลักษณะเฉพาะ. หากคุณต้องการทราบข้อมูลเพิ่มเติมเกี่ยวกับอนุภาคที่ประกอบขึ้นเป็นสสาร ให้อ่านบทความนี้ต่อไป
ดัชนี
- อะตอมคืออะไร?
- โครงสร้างของอะตอม
- ลักษณะสำคัญของอะตอม
- ไอโซโทปคืออะไร?
- อะตอมพบได้อย่างไรในธรรมชาติ?
อะตอมคืออะไร?
อะตอม มันคือ หน่วยที่เล็กที่สุดที่สามารถแบ่งสสารได้ โดยไม่สูญเสียคุณสมบัติทางเคมี กล่าวคือ คุณสมบัติของมันเป็นองค์ประกอบทางเคมี อะตอมคือต้นกำเนิดของทุกสิ่งที่มองเห็นหรือจับต้องได้ ตั้งแต่ดวงดาวจนถึงมื้อเช้าของคุณในเช้าวันนี้
ถ้าเรามองข้ามการสูญเสียคุณสมบัติทางเคมีของอะตอม เราสามารถพูดได้ว่าอะตอมประกอบด้วยอนุภาคต่างๆ ที่เรียกว่าอนุภาคย่อยของอะตอม อนุภาคย่อยมีสามประเภท -โปรตอน นิวตรอน และอิเล็กตรอน- ที่มีลักษณะแตกต่างกัน
อนุภาคเหล่านี้ถูกจัดกลุ่มเป็นตัวเลขต่างๆ เพื่อสร้างองค์ประกอบทางเคมี (ออกซิเจน คาร์บอน ฯลฯ) แต่จะกระจายไปตามโครงสร้างคงที่เสมอ

รูปภาพ: Google Sites
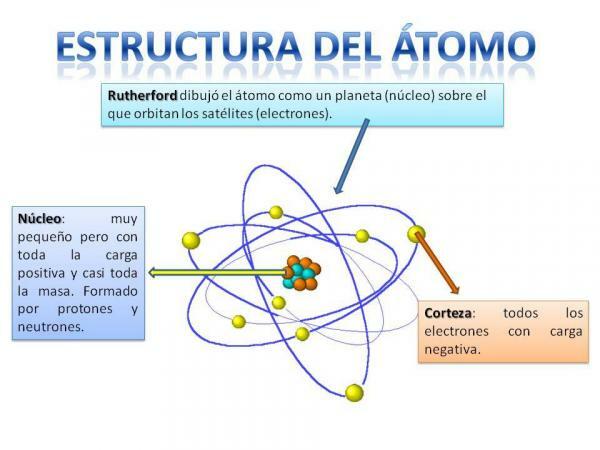
โครงสร้างของอะตอม
โครงสร้างของอะตอมได้รับการแก้ไขนั่นคือ เราสามารถมีอะตอมประเภทต่างๆ ได้ (อะตอมไฮโดรเจน อะตอมออกซิเจน ฯลฯ) แต่อนุภาคย่อยของอะตอมมักถูกจัดเรียงในลักษณะเดียวกันกับระบบดาวเคราะห์
คุณจะจำได้อย่างแน่นอนว่าระบบสุริยะจัดอย่างไร: ดวงอาทิตย์อยู่ตรงกลางและรอบ ๆ จากนี้ ดาวเคราะห์จะหมุนรอบโดยอธิบายวงโคจรที่แตกต่างกัน บางดวงอยู่ใกล้และบางดวงอยู่ห่างจาก อาทิตย์. ในกรณีของอะตอม ตรงกลางคือ แกนที่มีรูปร่างคล้ายแบล็กเบอร์รี่และประกอบด้วย นิวตรอน และ โปรตอน.
รอบแกนคือ Cortex ซึ่งเป็นบริเวณที่ อิเล็กตรอน. เมื่อก่อนคิดว่าอิเล็กตรอนอธิบายวงโคจรบางอย่าง คล้ายกับที่ดาวเคราะห์ทำ แม้ว่าตอนนี้จะเป็น รู้ว่าวงโคจรเหล่านี้ไม่ได้กำหนดไว้อย่างชัดเจนและเป็นเหมือนพื้นที่ที่เรามีแนวโน้มที่จะค้นพบตัวเองมากขึ้น อิเล็กตรอน
ภาพ: REA - แผน Ceibal
ลักษณะสำคัญของอะตอม
เพื่อดำเนินการต่อกับบทเรียนนี้เกี่ยวกับโครงสร้างของอะตอมและลักษณะเฉพาะ สิ่งสำคัญคือต้องเน้นที่องค์ประกอบที่ทำให้อะตอมได้รับการพิจารณาเช่นนั้น
และสำหรับสิ่งนี้ เราต้องตอบคำถามนี้: เหตุใดอะตอมทั้งหมดจึงตัดสินใจสั่งตัวเองในลักษณะที่แน่นอน? คำตอบนั้นง่าย: เป็นเพราะ แรงดึงดูดทางไฟฟ้า. นิวเคลียสของอะตอมประกอบด้วยนิวตรอนที่ไม่มีประจุไฟฟ้า และโปรตอนซึ่งมีประจุไฟฟ้าเป็นบวก และอิเล็กตรอนมีประจุไฟฟ้าเป็นลบ จึงมีแรงดึงดูดระหว่างนิวเคลียสและอิเล็กตรอนเหมือนกัน ผลิตขึ้นระหว่างสองขั้วของแม่เหล็ก แต่ไม่แรงพอที่อิเล็กตรอนจะ "ตกลง" ไปที่ แกน
สิ่งนี้จะเข้าใจได้ดีขึ้นถ้าเราคำนึงถึง ขนาดแกน: ถ้าอะตอมมีมิติของสนามฟุตบอล นิวเคลียสจะมีมิติของลูกบอลอยู่ตรงกลาง จากสนาม จะแรงดึงดูดขนาดไหนที่ลูกฟุตบอลจะต้องทำให้อัฒจันทร์ของสนามตกลงมา!
หน้าที่ของนิวตรอน
ตอนนี้คุณอาจสงสัยว่านิวตรอนมีบทบาทอย่างไร? แม้จะไม่มีประจุไฟฟ้า แต่นิวตรอนก็มีบทบาทอย่างมากในอะตอม: พวกมันมีส่วน 99% ของมวล ถ้ามันช่วยให้คุณจำได้ เราสามารถพูดได้ว่าอะตอมก็เหมือนแก๊งเพื่อนสามคน: หนัก นิวตรอน โปรตอนบวก และอิเล็กตรอนเชิงลบ ซึ่งหมุนรอบนิวตรอนและ อิเล็กตรอน.
การเคลื่อนที่ของอิเล็กตรอน
ณ จุดนี้ ฉันต้องการให้เรากลับไปที่สิ่งที่เราทิ้งไว้ในบ่อน้ำหมึก: วงโคจรที่อิเล็กตรอนอธิบายไว้รอบนิวเคลียส เราเคยพูดว่า อิเล็กตรอนหมุนรอบนิวเคลียส อย่างที่ดาวเคราะห์โคจรรอบดวงอาทิตย์ บางดวงอยู่ใกล้กว่าดวงอื่น ทำไมพวกมันถึงทำอย่างนั้น? อิเล็กตรอนจะหมุนในเปลือกหนึ่งหรืออีกชั้นหนึ่งตามพลังงานที่ต้องเคลื่อนออกจากนิวเคลียส กล่าวคือ อิเล็กตรอนที่อยู่ใกล้นิวเคลียสจะไม่มี แรงที่เพียงพอที่จะเคลื่อนออกจากนิวเคลียสในขณะที่ชั้นนอกสุด (ออร์บิทัล) ของเปลือกโลกมีพลังงานมากกว่าและสามารถเคลื่อนตัวออกห่างจากนิวเคลียสได้มากขึ้น แกน นอกจากนี้ ในแต่ละออร์บิทัลมีความจุสูงสุด 8 อิเล็กตรอน (กฎออกเตต).
อนุภาคของอะตอม
เราจะกลับไปที่แนวทางอื่นที่เราได้ทำไปแล้วก่อนหน้านี้ แต่ยังไม่ได้อธิบาย: อะตอมประกอบด้วย นิวตรอน โปรตอน และอิเล็กตรอนซึ่งมักจะรวมกันตามโครงสร้างเดียวกันของนิวเคลียสและเปลือกโลก แต่พวกมันทำในจำนวนที่ต่างกันเพื่อสร้างองค์ประกอบทางเคมีที่แตกต่างกัน เราจะเอาองค์ประกอบหลายๆ อย่างที่รวมอนุภาคเพียง 3 ประเภทเข้าด้วยกันได้อย่างไร? องค์ประกอบทางเคมีที่คุณเคยเห็นในตารางธาตุมีลักษณะเฉพาะโดยมีเลขอะตอมที่แน่นอน
เลขอะตอม (Z) แสดงถึงจำนวนโปรตอนในนิวเคลียสของอะตอมประเภทนี้ ซึ่งเท่ากับจำนวนอิเล็กตรอนในสภาวะปกติ ตัวอย่างเช่น อะตอมทั้งหมดที่มี 6 โปรตอน (Z = 6) จะเป็นอะตอมของคาร์บอน และจะมีคุณสมบัติทางเคมีเหมือนกัน อะตอมที่มีโปรตอน 5 ตัว (Z = 5) จะเป็นอะตอมโบรอนที่มีคุณสมบัติทางเคมีเหมือนกันและแตกต่างจากอะตอมของคาร์บอน คุณไม่ต้องสับสนเลขอะตอมกับน้ำหนักอะตอมหรือ เลขมวล (A)ซึ่งเป็นผลรวมของน้ำหนักของนิวตรอนและโปรตอน (น้ำหนักของอิเล็กตรอนจะน้อยมากเมื่อเทียบกับน้ำหนักของนิวเคลียสทั้งหมด)

ภาพ: SlidePlayer
ไอโซโทปคืออะไร?
ในธรรมชาติ เราสามารถพบ "ชนิดย่อย" ที่แตกต่างกันขององค์ประกอบ ไอโซโทป. ฉันแน่ใจว่าในบางจุดที่คุณเคยได้ยินเกี่ยวกับคาร์บอน 14 ซึ่งเป็นไอโซโทปกัมมันตภาพรังสีของคาร์บอนที่ใช้ในการกำหนดอายุของฟอสซิล ไอโซโทปคือ สองอะตอมที่มีจำนวนโปรตอนเท่ากัน (เลขอะตอมเดียวกัน) แต่จำนวนนิวตรอนต่างกัน (มวลอะตอมต่างกัน) โดยทั่วไปแล้วไอโซโทปของธาตุชนิดเดียวกันจะตั้งชื่อตามธาตุตามด้วยมวลอะตอม
ในตัวอย่างของเรา ไอโซโทปทั้งสองเป็นคาร์บอน ดังนั้นพวกมันจึงมีเลขอะตอมเท่ากับ 6 (Z = 6) แต่ คาร์บอน 12 (คาร์บอนปกติ) มีน้ำหนักอะตอมเท่ากับ 12 เทียบกับน้ำหนักอะตอมของคาร์บอน 14 14. ไอโซโทปของธาตุเดียวกันมีคุณสมบัติทางเคมีและกายภาพที่คล้ายกันมาก ในกรณีของคาร์บอน 14 ซึ่งแตกต่างจากคาร์บอน 12 คือไอโซโทปกัมมันตภาพรังสีที่มีอยู่ในองค์ประกอบทั้งหมดที่มีคาร์บอน รวมทั้งสิ่งมีชีวิต
และด้วยเหตุนี้ เราจึงจบบทเรียนนี้เกี่ยวกับโครงสร้างของอะตอมและลักษณะเฉพาะ เราหวังว่าสิ่งนี้จะช่วยคุณได้

ภาพ: งานของคุณ
อะตอมพบได้อย่างไรในธรรมชาติ?
อะตอมสามารถพบได้อย่างโดดเดี่ยว แต่สิ่งที่ปกติที่สุดคือการหามัน รวมกันเป็นกลุ่ม เรียกว่า โมเลกุล.
โมเลกุลสามารถประกอบขึ้นจากอะตอมของธาตุเดียวกันได้ (เช่น โมเลกุลออกซิเจน ประกอบด้วยอะตอมสองอะตอมของ ออกซิเจน) หรือโดยกลุ่มที่มีอะตอมของธาตุต่างกัน (ไฮโดรเจนสองอะตอมและออกซิเจนหนึ่งอะตอมสร้างโมเลกุลของ น้ำ). กลุ่มของธาตุเหล่านี้เรียกว่า โมเลกุล ซึ่งสามารถรวมเข้าด้วยกันและ สร้างกลุ่มที่แตกต่างกันมากขึ้นและซับซ้อนมากขึ้นตามปฏิกิริยาและความสัมพันธ์ทางเคมีสำหรับ แหล่งที่มาของ การเชื่อมโยงทางเคมี.
หากคุณต้องการอ่านบทความเพิ่มเติมที่คล้ายกับ โครงสร้างและลักษณะของอะตอมเราขอแนะนำให้คุณป้อนหมวดหมู่ของเรา อะตอม.



