กลูตาเมต (สารสื่อประสาท): ความหมายและหน้าที่
ดิ กลูตาเมต ไกล่เกลี่ย synapses excitatory ส่วนใหญ่ในระบบประสาทส่วนกลาง (CNS) มันเป็นสื่อกลางหลักของข้อมูลประสาทสัมผัส การเคลื่อนไหว ความรู้ความเข้าใจ และอารมณ์ และเกี่ยวข้องกับการก่อตัวของความทรงจำและการฟื้นตัวของความทรงจำ ซึ่งมีอยู่ใน 80-90% ของไซแนปสมอง
ราวกับว่าทั้งหมดนี้เป็นเพียงบุญเล็กๆ น้อยๆ มันยังเข้าไปแทรกแซงใน neuroplasticity กระบวนการเรียนรู้ และเป็นสารตั้งต้นของ กาบา – สารสื่อประสาทยับยั้งหลักของ CNS คุณจะถามอะไรอีกเกี่ยวกับโมเลกุล?
กลูตาเมตคืออะไร?
อาจจะ เป็นหนึ่งในสารสื่อประสาทที่มีการศึกษาอย่างกว้างขวางที่สุดในระบบประสาท. ในช่วงไม่กี่ปีที่ผ่านมา มีการศึกษาเพิ่มขึ้นเนื่องจากความสัมพันธ์กับโรคทางระบบประสาทต่างๆ (เช่น โรคอัลไซเมอร์) ซึ่งทำให้เป็นเป้าหมายยาที่มีประสิทธิภาพในโรคต่างๆ
นอกจากนี้ยังเป็นมูลค่าการกล่าวขวัญว่าเนื่องจากความซับซ้อนของตัวรับ นี่เป็นหนึ่งในสารสื่อประสาทที่ซับซ้อนที่สุดในการศึกษา
กระบวนการสังเคราะห์
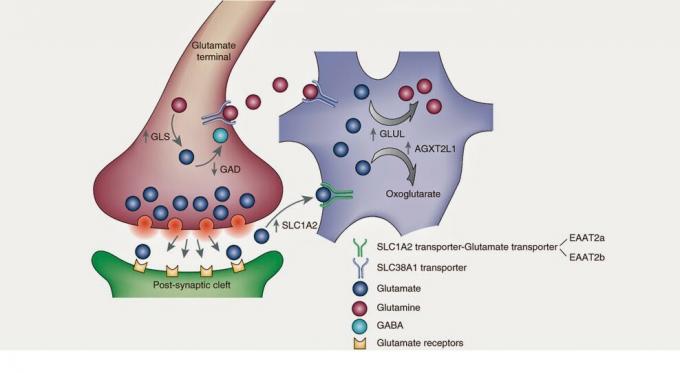
กระบวนการสังเคราะห์กลูตาเมตเริ่มต้นในวัฏจักรเครบส์หรือวัฏจักรกรดไตรคาร์บอกซิลิก วัฏจักรเครบส์เป็นวิถีเมแทบอลิซึมหรือเพื่อให้เราเข้าใจ ปฏิกิริยาเคมีต่อเนื่องกันเพื่อสร้างการหายใจระดับเซลล์ในไมโตคอนเดรีย
. วัฏจักรการเผาผลาญสามารถเข้าใจได้ว่าเป็นกลไกของนาฬิกาซึ่งแต่ละเกียร์จะทำหน้าที่ การทำงานและความล้มเหลวอย่างง่ายของชิ้นส่วนอาจทำให้นาฬิกาเสียหายได้หรือไม่ ชั่วโมง. วัฏจักรทางชีวเคมีเหมือนกัน โมเลกุลโดยปฏิกิริยาของเอนไซม์อย่างต่อเนื่อง - เกียร์ของนาฬิกา - เปลี่ยนรูปร่างและองค์ประกอบของมันเพื่อก่อให้เกิดการทำงานของเซลล์ สารตั้งต้นของกลูตาเมตหลักจะเป็น alpha-ketoglutarate ซึ่งจะได้รับหมู่อะมิโนโดยการทรานส์อะมิเนชันให้กลายเป็นกลูตาเมตนอกจากนี้ยังควรกล่าวถึงสารตั้งต้นที่สำคัญอีกอย่างหนึ่ง: กลูตามีน เมื่อเซลล์ปล่อยกลูตาเมตออกสู่พื้นที่นอกเซลล์ แอสโทรไซต์ - เซลล์ชนิดหนึ่ง glial - กู้คืนกลูตาเมตนี้ซึ่งผ่านเอนไซม์ที่เรียกว่า glutamine synthetase จะกลายเป็น กลูตามีน ต่อมา กลูตามีนถูกปลดปล่อยโดยแอสโตรไซต์ ซึ่งเซลล์ประสาทจะกู้คืนมาเพื่อเปลี่ยนกลับเป็นกลูตาเมต. และอาจมีมากกว่าหนึ่งคนที่ถามสิ่งต่อไปนี้ และหากพวกเขาต้องคืนกลูตามีนไปเป็นกลูตาเมตในเซลล์ประสาท เหตุใดแอสโตรไซต์จึงเปลี่ยนกลูตาเมตที่ไม่ดีเป็นกลูตามีน ฉันก็ก็ไม่รู้เหมือนกัน บางทีอาจเป็นเพราะแอสโทรไซต์และเซลล์ประสาทไม่เห็นด้วย หรือบางทีอาจเป็นเพราะ it ประสาท มันช่างซับซ้อน ไม่ว่าในกรณีใด ฉันต้องการทบทวน astrocytes เนื่องจากการทำงานร่วมกันคิดเป็น 40% ของ มูลค่าการซื้อขาย กลูตาเมต แปลว่า กลูตาเมตส่วนใหญ่จะถูกกู้คืนโดยเซลล์เกลียเหล่านี้.
มีสารตั้งต้นอื่น ๆ และวิถีทางอื่น ๆ โดยที่กลูตาเมตที่ถูกปล่อยสู่พื้นที่นอกเซลล์จะถูกกู้คืน ตัวอย่างเช่น มีเซลล์ประสาทที่มีตัวขนส่งกลูตาเมตเฉพาะ –EAAT1 / 2– ที่กู้คืนกลูตาเมตไปยังเซลล์ประสาทโดยตรงและปล่อยให้สัญญาณกระตุ้นถูกยุติ สำหรับการศึกษาเพิ่มเติมเกี่ยวกับการสังเคราะห์และเมแทบอลิซึมของกลูตาเมต ผมแนะนำให้อ่านบรรณานุกรม
ตัวรับกลูตาเมต
ตามที่พวกเขามักจะสอนเรา สารสื่อประสาทแต่ละตัวมีตัวรับบนเซลล์ postsynaptic. ตัวรับซึ่งอยู่บนเยื่อหุ้มเซลล์เป็นโปรตีนที่สารสื่อประสาท ฮอร์โมน จับ นิวโรเปปไทด์ ฯลฯ ทำให้เกิดการเปลี่ยนแปลงหลายชุดในการเผาผลาญของเซลล์ที่เซลล์ตั้งอยู่ ตัวรับ ในเซลล์ประสาท โดยทั่วไปเราวางตัวรับไว้บนเซลล์ postsynaptic แม้ว่าจะไม่จำเป็นต้องเป็นแบบนั้นจริงๆ
พวกเขามักจะสอนเราในปีแรกว่ามีตัวรับสองประเภทหลัก: ionotropic และ metabotropic Ionotropics เป็นสิ่งที่เมื่อลิแกนด์ของพวกเขา - "กุญแจ" ของตัวรับ - ผูกมัดพวกมันเปิดช่องที่อนุญาตให้ผ่านไอออนเข้าไปในเซลล์ ในทางกลับกัน Metabotropics เมื่อลิแกนด์จับกันทำให้เกิดการเปลี่ยนแปลงในเซลล์ผ่านผู้ส่งสารที่สอง ในการทบทวนนี้ ฉันจะพูดถึงประเภทหลักของตัวรับไอโอโนทรอปิกกลูตาเมต แม้ว่าฉันจะแนะนำให้ศึกษาวรรณกรรมเพื่อทำความเข้าใจตัวรับเมตาบอท นี่คือตัวรับไอโอโนทรอปิกหลัก:
- ตัวรับ NMDA
- ตัวรับแอมพา
- ตัวจับไคนาโด
ตัวรับ NMDA และ AMPA และความสัมพันธ์ที่ใกล้ชิด
เชื่อกันว่าตัวรับทั้งสองประเภทเป็นโมเลกุลขนาดใหญ่ที่ประกอบด้วยโดเมนทรานส์เมมเบรนสี่โดเมน - นั่นคือพวกมันประกอบด้วยสี่หน่วยย่อยที่ พวกเขาข้ามไขมัน bilayer ของเยื่อหุ้มเซลล์ - และทั้งคู่เป็นตัวรับกลูตาเมตที่จะเปิดช่องไอออนบวก - ไอออนที่มีประจุบวก แต่ถึงกระนั้นก็แตกต่างกันอย่างมาก
ความแตกต่างประการหนึ่งคือเกณฑ์ที่เปิดใช้งาน ประการแรก ตัวรับ AMPA สามารถเปิดใช้งานได้เร็วกว่ามาก ในขณะที่ตัวรับ NMDA ไม่สามารถเปิดใช้งานได้จนกว่าเซลล์ประสาทจะมีศักยภาพของเมมเบรนประมาณ -50mV - เซลล์ประสาทเมื่อถูกปิดใช้งานมักจะอยู่ที่ประมาณ -70mV- ประการที่สอง ขั้นตอนของไพเพอร์จะแตกต่างกันไปในแต่ละกรณี ตัวรับ AMPA จะได้รับศักยภาพของเมมเบรนที่สูงกว่าตัวรับ NMDA มาก ซึ่งจะทำงานร่วมกันอย่างสุภาพมากขึ้น ในทางกลับกัน ตัวรับ NMDA จะเปิดใช้งานได้อย่างต่อเนื่องมากกว่าตัวรับ AMPA เมื่อเวลาผ่านไป ดังนั้น, แอมพากระตุ้นอย่างรวดเร็วและสร้างศักยภาพกระตุ้นที่แข็งแกร่งขึ้น แต่ปิดการใช้งานอย่างรวดเร็ว. และของ NMDA ใช้เวลาในการเปิดใช้งาน แต่พวกเขาสามารถรักษาศักยภาพในการกระตุ้นที่พวกเขาสร้างขึ้นได้อีกต่อไป
เพื่อให้เข้าใจดีขึ้น ลองจินตนาการว่าเราเป็นทหารและอาวุธของเราเป็นตัวแทนของผู้รับที่แตกต่างกัน ลองนึกภาพว่าพื้นที่นอกเซลล์เป็นร่องลึก เรามีอาวุธสองประเภท: ปืนพกลูกโม่และระเบิดมือ ระเบิดนั้นใช้งานง่ายและรวดเร็ว: คุณถอดแหวนออก ทิ้งมันทิ้งและรอให้มันระเบิด พวกมันมีศักยภาพในการทำลายล้างมากมาย แต่เมื่อเราทิ้งพวกมันไปหมดแล้ว มันก็จบลง ปืนพกลูกโม่เป็นอาวุธที่ใช้เวลาในการโหลดเพราะคุณต้องถอดกลองออกแล้วใส่กระสุนทีละนัด แต่เมื่อเราบรรจุกระสุนแล้ว เรามีกระสุนหกนัด ซึ่งเราสามารถเอาตัวรอดได้ชั่วขณะ แม้ว่าจะมีศักยภาพน้อยกว่าระเบิดมือก็ตาม ปืนลูกโม่สมองของเราคือตัวรับ NMDA และระเบิดของเราคือตัวรับ AMPA
กลูตาเมตมากเกินไปและอันตรายของพวกเขา
พวกเขากล่าวว่าไม่มีอะไรดีเกินเลยและในกรณีของกลูตาเมตก็เป็นจริง แล้ว เราจะกล่าวถึงพยาธิสภาพและปัญหาทางระบบประสาทที่เกี่ยวข้องกับกลูตาเมตมากเกินไป.
1. สารอะนาล็อกของกลูตาเมตอาจทำให้เกิดความเป็นพิษต่อร่างกายได้
ยาที่คล้ายกับกลูตาเมต นั่นคือ ทำหน้าที่เหมือนกับกลูตาเมต เช่น NMDA ซึ่งตัวรับ NMDA เป็นหนี้ชื่อ สามารถทำให้เกิดผลต่อระบบประสาทในปริมาณที่สูงในบริเวณสมองที่เปราะบางที่สุด เช่น นิวเคลียสคันศรของไฮโปทาลามัส กลไกที่เกี่ยวข้องกับการเสื่อมสภาพของระบบประสาทนี้มีความหลากหลายและเกี่ยวข้องกับตัวรับกลูตาเมตประเภทต่างๆ
2. neurotoxins บางชนิดที่เรากินเข้าไปจะทำให้เซลล์ประสาทตายด้วยกลูตาเมตที่มากเกินไป
พิษต่างๆ ของสัตว์และพืชบางชนิดออกฤทธิ์ผ่านทางเส้นประสาทกลูตาเมต ตัวอย่างคือพิษจากเมล็ดของ Cycas Circinalis ซึ่งเป็นพืชมีพิษที่เราพบได้บนเกาะกวมในมหาสมุทรแปซิฟิก พิษนี้ทำให้เกิดความชุกของ .สูง เส้นโลหิตตีบด้านข้าง Amyotrophic บนเกาะนี้ที่ซึ่งผู้อยู่อาศัยกินเข้าไปทุกวัน เชื่อว่าไม่มีพิษภัย
3. กลูตาเมตมีส่วนทำให้เส้นประสาทขาดเลือดตาย
กลูตาเมตเป็นสารสื่อประสาทหลักในความผิดปกติของสมองเฉียบพลัน เช่น หัวใจวาย, ภาวะหัวใจหยุดเต้น, ภาวะขาดออกซิเจนก่อน/ปริกำเนิด. ในเหตุการณ์เหล่านี้ที่เนื้อเยื่อสมองขาดออกซิเจน เซลล์ประสาทยังคงอยู่ในสถานะขั้วแบบถาวร เนื่องจากกระบวนการทางชีวเคมีที่แตกต่างกัน สิ่งนี้นำไปสู่การปลดปล่อยกลูตาเมตออกจากเซลล์อย่างถาวรด้วยการกระตุ้นตัวรับกลูตาเมตอย่างต่อเนื่องในภายหลัง ตัวรับ NMDA สามารถซึมผ่านแคลเซียมได้เป็นพิเศษเมื่อเทียบกับตัวรับไอโอโนทรอปิกอื่นๆ และแคลเซียมที่มากเกินไปจะทำให้เซลล์ประสาทตายได้ ดังนั้นการมีสมาธิสั้นของตัวรับกลูตามาเตอจิกทำให้เซลล์ประสาทตายเนื่องจากแคลเซียมภายในเซลล์เพิ่มขึ้น
4. โรคลมบ้าหมู
ความสัมพันธ์ระหว่างกลูตาเมตและโรคลมชักได้รับการบันทึกไว้เป็นอย่างดี กิจกรรมโรคลมชักถือว่ามีความเกี่ยวข้องเป็นพิเศษกับตัวรับ AMPA แม้ว่าในขณะที่โรคลมชักดำเนินไป ตัวรับ NMDA ก็มีความสำคัญ
กลูตาเมตดีอย่างไร? กลูตาเมตไม่ดีหรือไม่?
โดยปกติ เมื่ออ่านข้อความประเภทนี้ เขาจะทำให้โมเลกุลมีมนุษยธรรมโดยติดป้ายกำกับว่า "ดี" หรือ "ไม่ดี" ที่มีชื่อและเรียกว่า มานุษยวิทยาทันสมัยมากในยุคกลาง ความเป็นจริงอยู่ค่อนข้างไกลจากการตัดสินแบบง่าย ๆ เหล่านี้
ในสังคมที่เราได้สร้างแนวคิดเรื่อง "สุขภาพ" ขึ้นมา มันเป็นเรื่องง่ายสำหรับกลไกบางอย่างของธรรมชาติที่จะรบกวนเรา ปัญหาคือธรรมชาติไม่เข้าใจ "สุขภาพ" เราสร้างสิ่งนี้ผ่านการแพทย์ อุตสาหกรรมยา และจิตวิทยา เป็นแนวคิดทางสังคม และเช่นเดียวกับแนวคิดทางสังคมอื่นๆ ที่อยู่ภายใต้ความก้าวหน้าของสังคม ไม่ว่าจะเป็นมนุษย์หรือทางวิทยาศาสตร์ ความก้าวหน้าแสดงให้เห็นว่ากลูตาเมตมีความเกี่ยวข้องกับโรคต่างๆ เช่น อัลไซเมอร์ หรือ โรคจิตเภท. นี่ไม่ใช่นัยน์ตาชั่วร้ายของการวิวัฒนาการของมนุษย์ แต่เป็นแนวคิดที่ไม่ตรงกันทางชีวเคมีของแนวคิดที่ธรรมชาติยังไม่เข้าใจ นั่นคือ สังคมมนุษย์ในศตวรรษที่ 21
และเช่นเคย ทำไมต้องศึกษาเรื่องนี้? ในกรณีนี้ ฉันคิดว่าคำตอบนั้นชัดเจนมาก เนื่องจากบทบาทที่กลูตาเมตมีต่อโรคทางระบบประสาทต่างๆ จึงส่งผลให้เป้าหมายทางเภสัชวิทยาที่สำคัญแม้ว่าจะซับซ้อนเช่นกัน. ตัวอย่างของโรคเหล่านี้ถึงแม้ว่าเราจะยังไม่ได้พูดถึงในรีวิวนี้เพราะฉันพิจารณา ว่าข้อความหนึ่งสามารถเขียนได้เฉพาะเกี่ยวกับเรื่องนี้คือโรคอัลไซเมอร์และ โรคจิตเภท. ส่วนตัวฉันพบว่าการค้นหายาใหม่สำหรับ โรคจิตเภทด้วยเหตุผลสองประการ: ความชุกของโรคนี้และค่ารักษาพยาบาล ถือ; และผลเสียของยารักษาโรคจิตในปัจจุบัน ซึ่งในหลายๆ กรณีเป็นอุปสรรคต่อการยึดมั่นในการรักษา
แก้ไขและแก้ไขข้อความโดย Frederic Muniente Peix
การอ้างอิงบรรณานุกรม:
หนังสือ:
- ซีเกล, จี. (2006). ประสาทเคมีพื้นฐาน อัมสเตอร์ดัม: เอลส์เวียร์.
บทความ:
- ซิทริ, เอ. & มาเลนก้า อาร์. (2007). Synaptic Plasticity: หลายรูปแบบ ฟังก์ชัน และกลไก Neuropsychopharmacology, 33 (1), 18-41. http://dx.doi.org/10.1038/sj.npp.1301559
- ฮาร์ดิงแฮม, จี. & ปาดิง, เอช. (2010). การส่งสัญญาณของตัวรับ NMDA Synaptic เทียบกับ extrasynaptic: นัยสำหรับความผิดปกติของระบบประสาท บทวิจารณ์เกี่ยวกับธรรมชาติ ประสาทวิทยาศาสตร์, 11 (10), 682-696. http://dx.doi.org/10.1038/nrn2911
- ฮาร์ดิงแฮม, จี. & ปาดิง, เอช. (2010). การส่งสัญญาณของตัวรับ NMDA Synaptic เทียบกับ extrasynaptic: นัยสำหรับความผิดปกติของระบบประสาท บทวิจารณ์เกี่ยวกับธรรมชาติ ประสาทวิทยาศาสตร์, 11 (10), 682-696. http://dx.doi.org/10.1038/nrn2911
- เคิร์ชเนอร์, จี. & นิโคล, อาร์. (2008). ไซแนปส์แบบเงียบและการเกิดขึ้นของกลไกโพสต์ซินแนปติกสำหรับ LTP บทวิจารณ์เกี่ยวกับธรรมชาติ ประสาทวิทยาศาสตร์, 9 (11), 813-825. http://dx.doi.org/10.1038/nrn2501
- ปาปูอิน, ที. & โอเลียต เอส. (2014). การจัดระเบียบ การควบคุม และการทำงานของตัวรับ NMDA ภายนอก ธุรกรรมเชิงปรัชญาของราชสมาคม B: Biological Sciences, 369 (1654), 20130601-20130601 http://dx.doi.org/10.1098/rstb.2013.0601
