เรขาคณิตโมเลกุล: ความหมายและตัวอย่าง
รูปร่างสามมิติ three ซึ่งอะตอมที่ประกอบเป็นโมเลกุลเรียกว่า is เรขาคณิตโมเลกุล หรือโครงสร้างโมเลกุล
เป็นไปได้ที่จะอนุมานเรขาคณิตของโมเลกุลเหล่านี้จากแบบจำลองทางทฤษฎี: แบบจำลองแรงขับของอิเล็กตรอนคู่ในเปลือกเวเลนซ์ (RPECV). โมเดลนี้มีประโยชน์อย่างยิ่งในการแสดงเรขาคณิตของโมเลกุลที่ประกอบด้วยอะตอมขนาดเล็กและเชื่อมโยงกันด้วยพันธะโควาเลนต์ (การแบ่งปันอิเล็กตรอน)
ในบทเรียนนี้จากครู เราจะค้นพบ คำจำกัดความของเรขาคณิตโมเลกุลและตัวอย่าง ด้วยวิธีนี้ คุณจะได้เรียนรู้ว่าแบบจำลอง RPECV ประกอบด้วยอะไร วิธีการอนุมานเรขาคณิตของโมเลกุลด้วยวิธีนี้และตัวอย่างบางส่วน
ดัชนี
- คำจำกัดความของเรขาคณิตโมเลกุล
- ตัวอย่างเรขาคณิตโมเลกุล
- รู้จักโครงสร้างลูอิสของโมเลกุล
- แบบจำลองการผลักคู่อิเล็กตรอนของวาเลนซ์เชลล์ (RPECV)
คำจำกัดความของเรขาคณิตโมเลกุล
เรขาคณิตโมเลกุลหรือโครงสร้างโมเลกุลคือ ทางอะตอม พบโมเลกุล ถูกจัดวางในอวกาศ.
โครงสร้างสามมิตินี้ (เรขาคณิตโมเลกุล) มา กำหนดโดยชุดของกองกำลัง ที่ยึดอะตอมไว้ด้วยกันในรูปแบบเฉพาะ ในบรรดาแรงที่กำหนดเรขาคณิตของโมเลกุลที่สำคัญที่สุดคือ ลิงค์ ว่า อะตอม นอนลงต่อกันเพื่อ ก่อตัวเป็นโมเลกุล.
เรขาคณิตของโมเลกุลมีความสำคัญมาก เพราะมันเป็นตัวกำหนดลักษณะทางเคมีกายภาพของสสาร ตัวอย่างเช่น: โมเลกุล H2O มีรูปทรงเชิงมุมที่กำหนดโดยพันธะที่ก่อตัวขึ้น การใช้รูปทรงมุมฉากนี้ทำให้โมเลกุลของน้ำเป็นไดโพลไฟฟ้าและมีคุณสมบัติพิเศษ ด้วยรูปทรงทางเรขาคณิต น้ำจึงเป็นของเหลวที่อุณหภูมิห้อง จึงสามารถละลายสารได้หลายชนิด ฯลฯ
เห็นได้ชัดว่าเมื่อพิจารณาจากขนาดของโมเลกุลแล้ว เรขาคณิตของพวกมันจะไม่สามารถสังเกตได้โดยตรงและต้องอนุมานด้วยวิธีทางอ้อม นอกจากนี้ จำเป็นต้องแสดงรูปทรงเรขาคณิตเหล่านี้โดยใช้แบบจำลองทางทฤษฎี
แบบจำลองทางทฤษฎีเหล่านี้ทำให้เราสามารถกำหนดว่าเรขาคณิตของโมเลกุลเป็นอย่างไรจากสูตรโมเลกุลของมัน
ตัวอย่างเรขาคณิตโมเลกุล
ดังที่เราได้เห็นในส่วนที่แล้ว อะตอมที่ประกอบเป็นโมเลกุลสามารถได้รับการจัดเรียงเชิงพื้นที่ที่แตกต่างกัน (เรขาคณิต) ในส่วนนี้ เราจะมาดูตัวอย่างเรขาคณิตของโมเลกุล
เรขาคณิตสองมิติ
ในบางกรณี โมเลกุลจะได้รูปทรงแบนหรือสองมิติ กล่าวคือ เป็นโครงสร้างที่มีเพียงสองมิติและครอบครองพื้นผิว (ไม่มีปริมาตร)
เรขาคณิตเชิงเส้น
เป็นเรขาคณิตที่ง่ายที่สุด เป็นเรื่องเกี่ยวกับโมเลกุลที่อะตอมเชื่อมต่อกันเป็นเส้นตรง โมเลกุลทั้งหมดที่ประกอบด้วยสองอะตอมเป็นเส้นตรง แต่เรขาคณิตนี้ยังเกิดขึ้นในโมเลกุลที่ประกอบด้วยสามอะตอม
ตัวอย่างของโมเลกุลเชิงเส้น:
เกิดจากสองอะตอม: ก๊าซไดอะตอมทั้งหมดเช่น O2, H2
ประกอบด้วยสามอะตอม: CO2 (คาร์บอนไดออกไซด์)
เรขาคณิตเชิงมุม
พวกมันคือโมเลกุลที่ประกอบด้วยสามอะตอมที่มารวมกันเป็นมุม แอมพลิจูดของมุมที่เกิดขึ้นอาจแตกต่างกันไปขึ้นอยู่กับประเภทของอะตอมที่ก่อตัว แอมพลิจูดของมุมที่เกิดจากโมเลกุลเชิงมุมมีค่าระหว่าง90ºและ120º
ตัวอย่าง: H2O, SO2 (ซัลเฟอร์ไดออกไซด์), SnCl2 (ทินไดคลอไรด์)
เรขาคณิตสามเหลี่ยม
พวกมันคือโมเลกุลที่ประกอบด้วยสี่อะตอม โดยหนึ่งอะตอมตั้งอยู่ตรงกลางของสามเหลี่ยมจินตภาพ และอีกสามอะตอมที่เหลืออยู่ในจุดยอดแต่ละจุดของสามเหลี่ยม
ตัวอย่าง: SO3 (ซัลเฟอร์ไตรออกไซด์), NO3- (ไนเตรตไอออน)
เรขาคณิตสี่เหลี่ยม
โมเลกุลที่มีรูปทรงนี้มี 5 อะตอม อันหนึ่งตั้งอยู่ตรงกลางสี่เหลี่ยมจัตุรัส และอีก 4 อันอยู่ในจุดยอดแต่ละอันของรูป
ตัวอย่าง: XeF4 (ซีนอนไตรฟลูออไรด์)
เรขาคณิตสามมิติ
พวกมันมีสามมิติ นั่นคือ พวกมันมีปริมาตร เรขาคณิตของโมเลกุล 3 มิติมีความหลากหลายมาก ในที่นี้เราจะดูตัวอย่างเพียงไม่กี่
เรขาคณิตจัตุรมุข
เรขาคณิตนี้เป็นรูปทรงเรขาคณิตที่นำเสนอโดยโมเลกุลบางตัวที่เกิดจากอะตอมห้าอะตอมในนั้นจะมีอะตอมอยู่ใน located ศูนย์กลางของลูกบาศก์จินตภาพและอะตอมที่เหลืออีกสี่อะตอมจะอยู่ที่จุดยอดของลูกบาศก์ (จัตุรมุข)
ตัวอย่าง: CH4 (มีเทน), MnO4-(เปอร์แมงกาเนตไอออน)
เรขาคณิตเสี้ยมตรีโกณมิติ
พวกมันคือโมเลกุลที่มีอะตอมสี่ตัวจัดเรียงกันที่จุดยอดทั้งสี่ของปิรามิดที่มีฐานเป็นรูปสามเหลี่ยม
ตัวอย่าง: NH3 (แอมโมเนีย), PH3 (ฟอสฟีน)
เรขาคณิตเสี้ยมทรงสี่เหลี่ยม
ในกรณีนี้ จำนวนอะตอมที่ประกอบเป็นโมเลกุลคือหกและห้าอะตอมจะจัดเรียงอยู่ใน จุดยอดของปิรามิดที่มีฐานสี่เหลี่ยมในขณะที่จุดหกตรงบริเวณศูนย์กลางของสี่เหลี่ยมจัตุรัสของ of ฐาน.
ตัวอย่าง: ClF5 (คลอรีนเพนตาฟลูออไรด์)
รู้จักโครงสร้างลูอิสของโมเลกุล
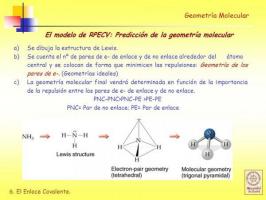
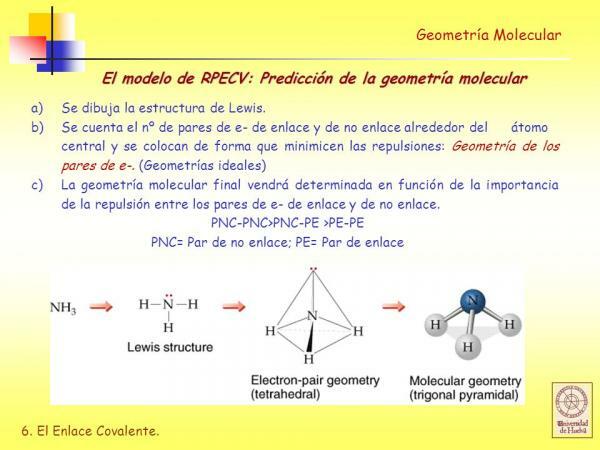
ก่อนที่คุณจะสามารถใช้ วิธี RPECV จำเป็นต้องรู้ว่ามันคืออะไร โครงสร้างลูอิส ของโมเลกุลและสำหรับสิ่งนี้คุณต้องรู้ก่อนว่า การกำหนดค่าทางอิเล็กทรอนิกส์จากชั้นบาเลนเซีย ของอะตอมต่างๆ ที่ประกอบเป็นโมเลกุล
ดังนั้นก่อนที่จะกำหนดเรขาคณิตของโมเลกุลได้ จำเป็นต้องดำเนินการตามขั้นตอนเบื้องต้นดังนี้
- ถึง. รับการกำหนดค่าอิเล็กตรอน ของอะตอมต่างๆ ที่ประกอบเป็นโมเลกุล
- ข. กำหนดจำนวนอิเล็กตรอนของเปลือกวาเลนซ์ ของแต่ละอะตอม อิเล็กตรอนในเปลือกเวเลนซ์คืออิเล็กตรอนที่อะตอมสามารถใช้เพื่อสร้างพันธะ
- ค. อนุมานโครงสร้างลูอิส โดยคำนึงถึงจำนวนอิเล็กตรอนที่แต่ละอะตอมมีอยู่ในเปลือกเวเลนซ์
ภาพ: Slideplayer
แบบจำลองการผลักคู่อิเล็กตรอนของวาเลนซ์เชลล์ (RPECV)
ใน โครงสร้างลูอิส แต่ละอะตอมที่ถูกผูกมัดจะต้องพบกับ กฎออคเต็ต เมื่ออะตอมปฏิบัติตามกฎออคเต็ต อะตอมจะถูกล้อมรอบด้วยอิเล็กตรอนสี่คู่ที่สามารถเป็นอิเล็กตรอนที่เป็นส่วนหนึ่งของ พันธะ (พันธะคู่อิเล็กตรอน) หรือคู่อิเล็กตรอนที่ไม่มีส่วนร่วมในการก่อตัวของพันธะ (คู่อิเล็กตรอนไม่ ผูกพัน).
ดังที่เราจะได้เห็นกัน เมื่อโครงสร้างลูอิสของโมเลกุลถูกกำหนดแล้ว ให้อนุมานได้ว่า เรขาคณิตโดยใช้แบบจำลองแรงขับของคู่อิเล็กตรอนของเปลือกเวเลนซ์มีค่ามาก ง่าย.
ตามแบบจำลองการแสดงนี้ ลิแกนด์ (X) และคู่อิเล็กตรอนที่ไม่ผูกมัด (E) ถูกจัดเรียงรอบอะตอมกลาง (A) เพื่อให้ระยะห่างระหว่างพวกมันมีค่าสูงสุด ผลรวมของลิแกนด์และคู่อิเล็กตรอนที่ไม่ผูกมัด (X + E) กำหนดประเภทของเรขาคณิตของโมเลกุล
X + E = 2
เรขาคณิตเชิงเส้น
AX2: โมเลกุลที่เกิดจากลิแกนด์สองอะตอมที่เกาะกับอะตอมกลาง central
ตัวอย่าง: เบริลเลียมไฮไดรด์ (BeH2)
X + E = 3
เรขาคณิตระนาบสามเหลี่ยม (สามเหลี่ยมด้านเท่า)
AX3: โมเลกุลประกอบด้วยสามอะตอมที่ยึดติดกับอะตอมกลาง
ตัวอย่าง: คลอไรด์บางชนิด เช่น โบรอนหรืออะลูมิเนียม (BCl3, AlCl3)
เรขาคณิตเชิงมุม (มุม120º)
AX2E: โมเลกุลที่มีอะตอมตรงกลางติดอยู่กับลิแกนด์สองตัวและอิเล็กตรอนคู่หนึ่งที่ไม่มีพันธะ
ตัวอย่าง: ทิน (II) คลอไรด์ (Sn2Cl)
X + E = 4
เรขาคณิตจัตุรมุข
AX4: โมเลกุลที่มีอะตอมตรงกลางมีแกนด์สี่ตัวเรียงตัวกันเป็นพันธะเพื่อให้แกนด์เป็น พวกมันมีลูกบาศก์ที่จุดยอดของเส้นทแยงมุมตรงข้ามซึ่งมีศูนย์กลางอยู่ที่อะตอมกลาง
ตัวอย่าง: โมเลกุล เช่น มีเทน (CH4) ซิลิกอนคลอไรด์ (SiCl4) หรือคาร์บอนเตตระคลอไรด์ (CCl4) นำเสนอเรขาคณิตนี้
เรขาคณิตพีระมิดตรีโกณมิติ
AX3E: โมเลกุลที่มี 3 ลิแกนด์และ 1 คู่อิเล็กตรอนเดี่ยวซึ่งอะตอมของลิแกนด์ทั้งสามถูกจัดเรียงให้ก่อตัว ฐานของปิรามิดที่มีฐานเป็นรูปสามเหลี่ยมซึ่งอะตอมกลางอยู่ในจุดยอดบนของดังกล่าว ปิรามิด
ตัวอย่าง: หนึ่งในโมเลกุลที่มีรูปทรงนี้คือแอมโมเนีย (NH3)
เรขาคณิตเชิงมุม (มุม109º)
AX2E2: ลิแกนด์สองตัวและอะตอมตรงกลางเรียงตัวกันเป็นมุม109º
ตัวอย่าง: น้ำ (H2O) เป็นหนึ่งในโมเลกุลที่มีรูปทรงนี้
Gเรขาคณิตเชิงเส้น
AX3: เนื่องจากมีลิแกนด์เพียงตัวเดียวติดอยู่กับอะตอมกลาง เรขาคณิตจึงเป็นเส้นตรง
ตัวอย่าง: ไฮโดรเจนฟลูออไรด์หรือกรดไฮโดรฟลูออริก (HF)
X + E = 5
เรขาคณิตไบพีระมิดแบบตรีโกณมิติ
AX5: โมเลกุลนี้มีรูปเรขาคณิตของปิรามิดที่อยู่ตรงข้ามกัน 2 อัน โดยมีฐานรูปสามเหลี่ยมร่วมกันทั้งสอง อะตอมตรงกลางถูกจัดเรียงไว้ตรงกลาง ส่วนลิแกนด์จะอยู่ที่จุดยอด
ตัวอย่าง: ฟอสฟอรัสเพนทาคลอไรด์ (PCl5)
เรขาคณิตไดชีนอยด์
AX4E: ในเรขาคณิตประเภทนี้ อะตอมจะได้รับการจัดเรียงที่คล้ายกับโครงสร้างของชิงช้ากระดานหก
ตัวอย่าง: Tetra sulfur fluoride (SF4)
เรขาคณิต T
AX3E2: โมเลกุลมีรูปร่างเหมือนตัวอักษร T โดยมีแกนด์อยู่ที่ปลายตัวอักษรและอะตอมตรงกลางอยู่ที่จุดที่เส้นสองเส้นที่มาบรรจบกัน
ตัวอย่าง: คลอรีนไตรฟลูออไรด์ (ClF3)
เรขาคณิตเชิงเส้น
AX2E3: ในกรณีนี้ อะตอมทั้งสามของโมเลกุลจะจัดเรียงตามอะตอมกลางในตำแหน่งตรงกลาง
ตัวอย่าง: ซีนอนไดฟลูออไรด์ (F2Xe)
X + E = 6
เรขาคณิตแปดด้าน
AX6: โมเลกุลประเภทนี้มีโครงสร้างที่คล้ายกับรูปแปดด้านซึ่งอะตอมกลางจะครอบครองจุดศูนย์กลางของรูปทรงเรขาคณิตและแกนด์ทั้งหกจุดแต่ละจุด
ตัวอย่าง: ซัลเฟอร์เฮกซาฟลูออไรด์ (SF6)
พีระมิดฐานสี่เหลี่ยม
AX5E: ในกรณีนี้ อะตอมจะก่อตัวเป็นรูปที่อะตอมกลางตรงบริเวณศูนย์กลางของฐานและแกนด์จับจุดยอดทั้งห้าของรูป
ตัวอย่าง: โบรมีนเพนทาฟลูออไรด์ (BrF5)
เรขาคณิตสี่เหลี่ยมระนาบ
AX4E2: อะตอมได้รับการจัดเรียงรูปสี่เหลี่ยมจัตุรัสซึ่งอะตอมกลางตรงบริเวณจุดศูนย์กลางของรูปและลิแกนด์แต่ละจุด
ตัวอย่าง: ซีนอนเตตระฟลูออไรด์ไอออน (XeF4)

หากคุณต้องการอ่านบทความเพิ่มเติมที่คล้ายกับ เรขาคณิตโมเลกุล: ความหมายและตัวอย่างเราขอแนะนำให้คุณป้อนหมวดหมู่ของเรา อะตอม.
บรรณานุกรม
Alejandrina Gallego Picó, Rosa Mª Garcinuño Martínez, Mª José Morcillo Ortega, Miguel Ángel Vázquez Segura (2018) เคมีพื้นฐาน. มาดริด: Uned