PERİYODİK TABLO'nun Evrimi: Yaratılışından Günümüze
Periyodik tablo bunlardan biridir. en ikonik simgeler bilimin. 2019, kuruluşunun 150. yıldönümü olmasına rağmen, hiçbir şekilde tamamlanmış bir belge değildir. Bir ÖĞRETMENden alınan bu derste, neler olduğunu göreceğiz. periyodik tablonun evrimi Yaratılışından günümüze kadar atomlar ve özellikleriyle ilgili bilgideki gelişmeler bunu mümkün kılmıştır.
dizin
- Periyodik tablo nedir?
- İlk periyodik tablo: köken
- Periyodik tablonun tarihi ve evrimi
Periyodik tablo nedir?
periyodik tablo Periyodik elementler sistemi, daha az alanda daha fazla bilgiyi toplayan ve bilimin en güçlü simgelerinden birini oluşturan bilimsel belgedir. iyi bir bölümünü içerir. Kimya hakkında sahip olduğumuz bilgiler. Başka hiçbir bilim dalında buna benzer bir belge yoktur.
Elementlerin periyodik tablosu bir kimyasal elementlerin sınıflandırma sistemi 200 yıldan fazla bir süre önce başladı. Bu sınıflandırma sistemi, bilim ilerledikçe ve yenileri keşfedildikçe zaman içinde büyüyor ve değişiyor.
kimyasal elementler. Bununla birlikte, temel yapısını sağlam tutarak çeşitli modifikasyonlar dahil edilmiştir.Periyodik tablo böyle adlandırılmıştır çünkü grafiksel olarak ifade eder belirli aralıklarla tekrarlama biçimleri kimyasal özellikler. İki boyutlu bir temsil türüdür veya daha modern temsillerinde üç boyutludur.
İçinde klasik periyodik tablo (iki boyutlu) kimyasal elementler düzenlenir gruplar veya aileler ve mevcut periyodik tabloda dikey sütunlarda temsil edilir. Bu grupların sütunlardaki sıralı düzeni, elementlerin atom ağırlıklarına göre sıralandığı, periyot adı verilen bir dizi sıraya yol açar. Periyodik tablo, uzunlukları değişen yedi periyottan oluşur.

İlk periyodik tablo: köken.
Mendeleev'den önce, diğer bilim adamları kimyasal elementler için sınıflandırma sistemleri geliştirmişlerdi. Ancak, elementlerin periyodik tablosundan farklı olarak, sadece bilinen elementlerin listeleri; Periyodik tablo, iki boyutlu (satırlar) bir sınıflandırma sistemi olma özelliğine sahipken, ve sütunlar) veya kimyasal elementlerin art arda düzenlendiği en modern versiyonlarında üç boyut katmanlar.
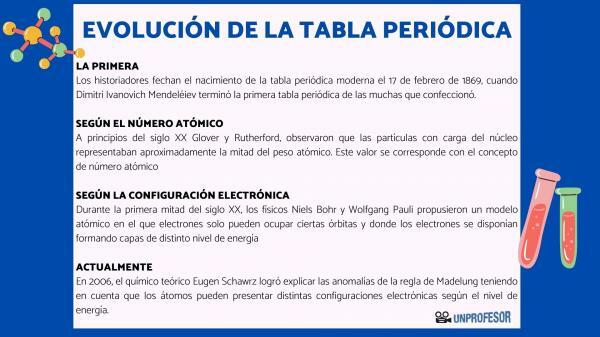
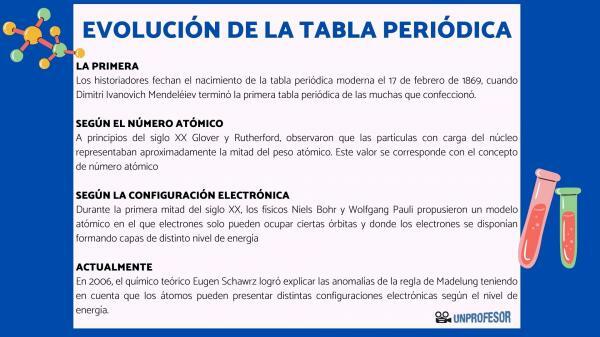
Bu nedenle tarihçiler modern periyodik tablonun doğuşunu 17 Şubat 1869, ne zaman Dimitri İvanoviç Mendeleyev bitirmek ilk periyodik tablo yaptığı birçok şeyden. Bu tablo, ailelere göre düzenlenmiş 63 elementten oluşuyordu ve henüz olmayan elementler için boşluk bıraktı. keşfetti, ancak atom ağırlıklarını çıkardığı (Galyum, Germanyum ve skandiyum)
Periyodik tablonun keşfi için anahtar veriler, daha önceki bilgilerdi. atom ağırlığı her elemanın.
Atom ağırlığı ve atom numarası nedir?
Bu numara atomun ağırlığını temsil etti ve ölçülebilir tek değerdi. atomlar. Ama hiçbir durumda doğrudan ölçümler değildi (izole atomların tartılmasına izin veren hiçbir ölçüm cihazı yoktur), daha ziyade kurulmuş bir sistemdi. hidrojen atomuna keyfi bir 1 değerinin verildiği ve kalan elementlerin atom ağırlığının değerinin buna göre hesaplandığı bir standart Desen.
İlk hesaplamalar atomik numara elementlerin bir İngiliz kimyager tarafından gerçekleştirildi John dalton19. yüzyılın ilk yarısında büyük bir bilimsel tartışma yarattı. Ancak, 19. yüzyılın ikinci yarısında, elementlerin atom ağırlıklarını hesaplama sistemi üzerinde zaten dikkate değer bir fikir birliği vardı. Atom ağırlığı, Mendeleev'den itibaren, elementlerin periyodik tablodaki doğru sıralanması için önemli bir kriter haline geldi.
Mendeleyev bilinen elementleri özelliklerine göre sıraladığında artan atom ağırlığı, öğelerin birbirine benzeyen öğe grupları veya aileleri halinde gruplandırılmasına izin veren yinelenen özelliklerin görünümünü gözlemledi. Ancak bazı durumlarda elementlerin atom ağırlıklarına göre sıralanması, gözlenen elementler arasındaki benzerliklere cevap vermemiş ve Mendeleev değişmiştir. 17 elementin atom ağırlıklarına rağmen periyodik tablodaki konumu, analoji sundukları elementlerle gruplandırabilmek için.
Bu değişiklikler, kabul edilen bazı atom ağırlıklarının doğru olmadığını ve yeniden hesaplandığını gösterdi. Atom ağırlıklarındaki düzeltmelere rağmen, hala atom ağırlıklarının gösterdiği konumlardan farklı konumlara yerleştirilmesi gereken elementler vardı.

Resim: BBC.com
Periyodik tablonun tarihi ve evrimi.
Mendeleev'in şüphesiz katkısına rağmen, periyodik element tablosu tek bir araştırmacının çalışmasının sonucu değildir. Mendeleev'e ek olarak, on dokuzuncu yüzyılın ikinci yarısında ve yirminci yüzyıl boyunca birçok Kimyagerler, kimyasal elementler hakkında bilgi düzenlemenin en iyi yolunu araştırmaya devam etti bilinen. Daha da fazlası, bu süre zarfında keşfin yeni kimyasal elementler veya basit maddelerspektrometri (atomlar ve elektromanyetik radyasyon arasındaki etkileşimleri inceleyen) sayesinde.
elementlerin sınıflandırılması Periyodik tablo, başlangıçta, başlangıç hesaplamalarına dayanıyordu. atom ağırlıkları öğelerin benzer ailelerde gruplandırılmasına izin veren analojileri ortaya çıkardı. Buna rağmen, bu periyodik özelliklerin ortaya çıkış nedeni açıklanamamıştır. Elementlerin özelliklerindeki bu periyodikliğin sebebinin anlaşıldığı tarihler ise 20. yüzyıl boyunca, elektronik yapının keşfi ile olmuştur.
Sıralama düzeni olarak atom numarası
20. yüzyılın başında Glover ve Rutherford, çekirdekteki yüklü parçacıkların atom ağırlığının yaklaşık yarısını oluşturduğunu gözlemledi. Bu değer kavramına karşılık gelir. atomik numara atom çekirdeğindeki proton sayısı olarak tanımlanan ve nötr bir atomdaki elektron sayısı ile çakışan. Bu yeni değer, o zamana kadar gerçekleştirilen belirli unsurların konumlarındaki değişiklikleri haklı çıkardı. Örneğin Tellür ve İyot arasındaki pozisyon değişikliği.
1913 yılında Henry Moseley tablonun sırasını, X-ışını spektrometrisi ile atom numarasının bir fonksiyonu olarak doğruladı. Atom numarasına göre sıralama günümüzde de yürürlüktedir.
Aynı zamanda, 20. yüzyıl boyunca, kuantum mekaniği sayesinde yeni kimyasal elementler keşfedilmeye devam etti. atomların parçacıklar tarafından bombardımanı, yüzyılın ikinci yarısından itibaren. Bu yeni teknikle oluşturmak mümkün oldu yapay elementler doğada bulunmayanlardır.
Periyodik tablodaki elementlerin doğru düzenlenmesinde ilerleme kaydedilmesine rağmen, yine de belirli özelliklerin tekrar tekrar ortaya çıkmasının nedeni (özellikler periyodik). gelişimi Kuantum mekaniği (ışık ve atomların davranışını mikroskobik ölçekte inceleyen fizik dalı) 1920'den itibaren bu özelliklerin nedenini açıklamak için belirleyici oldu.
Periyodik özelliklerin bir açıklaması olarak elektronik konfigürasyon
20. yüzyılın ilk yarısında fizikçiler Niels Bohr Y Wolfgang Pauli elektronların yalnızca belirli yörüngeleri işgal edebileceği ve elektronların farklı enerji seviyelerinde katmanlar oluşturacak şekilde düzenlendiği bir atom modeli önerdiler. Elektronların farklı kabuklardaki veya enerji seviyelerindeki yörüngelerde dağılma şekli olarak bilinir. elektronik konfigürasyon.
Elektron konfigürasyonlarındaki elektronların düzenlenmesinin keşfi, özelliklerin periyodikliğini anlamak için temeldi. periyodik olarak, bu özelliklerin atomların en dıştaki elektronik konfigürasyonu (katman katmanı) ile yakından ilişkili olduğu gözlendiğinden, Valensiya).
Elektronların atomik yörüngeleri doldurma sırası 1930 yılında fizikçi Erwin Madelung tarafından doldurulma düzeni için sayısal bir kural oluşturmuştur. Bu kural olarak bilinir Madelung kuralı ve kuantum mekaniği ile açıklanamayan ampirik bir kuraldır.
Doldurma sırası, periyodik tablonun ilk üç satırı için basittir, ancak geçiş elemanlarının bulunduğu dördüncü sıra, doldurma sırası bir dizi değişiklikler. Bu kurala uymayan toplam 20 anormal öğe var.
Tablonun evrimi bugün de devam ediyor
2006 yılında teorik kimyager Eugen Schawrz Atomların enerji seviyesine bağlı olarak farklı elektronik konfigürasyonlara sahip olabileceğini hesaba katarak Madelung kuralının anormalliklerini açıklamayı başardı. Ortalamaları hesaplarken, çoğu elementin elektron konfigürasyonları Madelung kuralına uygundur.
Periyodik tablo 21. yüzyılda tartışma konusu olmaya devam etse de, periyodik tablonun düzenlenmesi veya elektronik konfigürasyonu. elemanları, bu sıralamayı ve elektronik konfigürasyonlarda gözlenen anormallikleri bir teori.
Buna benzer daha fazla makale okumak istiyorsanız Periyodik tablonun evrimi - özet, kategorimize girmenizi tavsiye ederiz. Atom.
bibliyografya
Çeşitli yazarlar. (2019)Özel: periyodik tablo. Araştırma ve bilim. Barselona: Scientific Press S.A.
