MOLEKÜLER geometri: tanım ve örnekler
üç boyutlu şekil Bir molekülü oluşturan atomların düzenlendiği yere ne ad verilir? Moleküler geometri veya moleküler yapı.
Bu moleküllerin geometrisini teorik bir modelden çıkarmak mümkündür: değerlik kabuğundaki elektron çiftlerinin itme modeli (RPECV). Bu model, özellikle küçük atomlardan oluşan ve kovalent bağlarla (elektron paylaşımı) birbirine bağlanan moleküllerin geometrisini temsil etmek için kullanışlıdır.
Bir ÖĞRETMENden aldığımız bu derste, moleküler geometrinin tanımı ve örnekleri Böylece RPECV modelinin nelerden oluştuğunu, bu yöntemle moleküllerin geometrisinin nasıl çıkarılabileceğini ve bazı örnekleri öğrenebilirsiniz.
dizin
- Moleküler geometrinin tanımı
- Moleküler geometri örnekleri
- Molekülün Lewis yapısını bilir
- Değerlik kabuğunun (RPECV) elektron çifti itme modeli
Moleküler geometrinin tanımı.
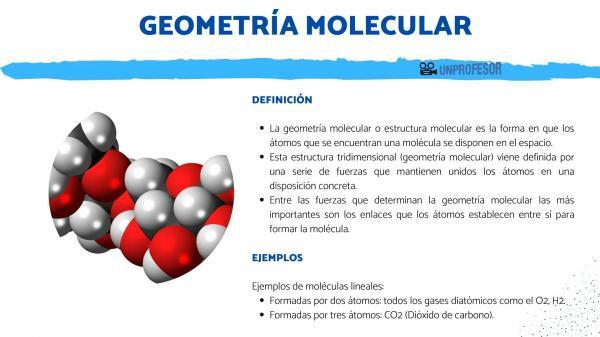
Moleküler geometri veya moleküler yapı atomların yolu bir molekül buldum uzayda düzenlenir.
Bu üç boyutlu yapı (moleküler geometri) geliyor
bir dizi kuvvet tarafından tanımlanan atomları belirli bir düzende bir arada tutan Moleküler geometriyi belirleyen kuvvetler arasında en önemlileri şunlardır: bağlantılar ki atomlar birbirinize uzanmak molekülü oluşturmak.Moleküllerin geometrisi çok önemlidir çünkü maddenin fizikokimyasal özelliklerinin neler olduğunu belirler. Örneğin: H2O molekülleri, kendisini oluşturan bağlar tarafından verilen açısal bir geometriye sahiptir. Bu açılı geometriyi benimsemek, su molekülünü bir elektrik dipolü yapar ve olağanüstü özelliklere sahiptir. Su, geometrisi sayesinde oda sıcaklığında sıvıdır, birçok maddeyi vb. çözebilir.
Açıktır ki, moleküllerin boyutu göz önüne alındığında, geometrileri doğrudan gözlemlenemez ve dolaylı yöntemlerle çıkarsanması gerekir. Ayrıca bu geometrilerin teorik modeller aracılığıyla temsil edilmesi gerekmektedir.
Bir molekülün geometrisinin moleküler formülünden nasıl olduğunu belirlememize izin veren bu teorik modellerdir.
Moleküler geometri örnekleri.
Bir önceki bölümde gördüğümüz gibi, bir molekülü oluşturan atomlar farklı uzamsal düzenlemeler (geometriler) elde edebilirler. Bu bölümde moleküler geometrinin bazı örneklerini göreceğiz.
İki boyutlu geometriler
Bazı durumlarda, moleküller düz veya iki boyutlu geometriler kazanırlar, yani sadece iki boyutu olan ve bir yüzey kaplayan (hacimleri olmayan) yapılardır.
Doğrusal geometri
En basit geometridir, atomları düz bir çizgi oluşturacak şekilde birleştirilen moleküllerle ilgilidir. İki atomdan oluşan tüm moleküller doğrusaldır, ancak bu geometri üç atomdan oluşan moleküllerde de oluşur.
Doğrusal molekül örnekleri:
İki atomdan oluşur: O2, H2 gibi tüm iki atomlu gazlar.
Üç atomdan oluşur: CO2 (Karbondioksit).
açısal geometri
Bir açıyla bir araya gelen üç atomdan oluşan moleküllerdir. Oluşan açının genliği, onu oluşturan atomların türüne bağlı olarak farklı olabilir. Açısal moleküllerin oluşturduğu açıların genlikleri 90º ile 120º arasında değerlere sahiptir.
Örnekler: H2O, SO2 (kükürt dioksit), SnCl2 (kalay diklorür)
üçgen geometri
Bir atom hayali bir üçgenin merkezinde ve diğer üç atom bu üçgenin her bir köşesinde yer alan diğer üç atomdan oluşan dört atomdan oluşan moleküllerdir.
Örnekler: SO3 (kükürt trioksit), NO3- (nitrat iyonu)
kare geometri
Bu geometriye sahip moleküllerin 5 atomu vardır. Biri bir karenin merkezinde, diğeri ise şeklin her bir köşesinde bulunur.
Örnekler: XeF4 (Ksenon triflorür)
Üç boyutlu geometriler
Üç boyutları vardır, yani hacimleri vardır. 3D moleküllerin geometrileri çok çeşitlidir, burada sadece birkaç örnek göreceğiz.
dörtyüzlü geometri
Bu geometri, içinde bir atom bulunan beş atomdan oluşan bazı moleküller tarafından sunulan geometridir. hayali bir küpün merkezi ve kalan dört atom, küpün (tetrahedron) köşelerinde bulunur.
Örnek: CH4 (metan), MnO4-(permanganat iyonu)
Üçgen piramidal geometri
Üçgen tabanlı bir piramidin dört köşesine yerleştirilmiş dört atomlu moleküllerdir.
Örnek: NH3 (amonyak), PH3 (fosfin)
Dörtgen piramidal geometri
Bu durumda molekülü oluşturan atomların sayısı altıdır ve bunlardan beş tanesi kare tabanlı bir piramidin köşeleri, altıncı ise piramidin karesinin merkezini kaplar. baz.
Örnek: ClF5 (klor pentaflorür)
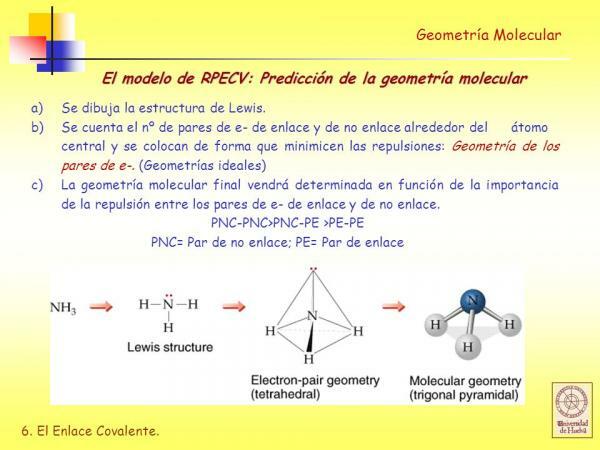
Molekülün Lewis yapısını bilir.
Kullanmadan önce RPECV yöntemi ne olduğunu bilmek lazım Lewis yapısı molekülün ve bunun için önce ne olduğunu bilmelisiniz. elektronik konfigürasyonValencia katmanından molekülü oluşturan farklı atomların
Bu nedenle, bir molekülün geometrisini belirlemeden önce, önceki bazı adımların gerçekleştirilmesi gerekir:
- İÇİN. Elektron konfigürasyonlarını alın molekülü oluşturan farklı atomların
- B. Değerlik kabuğu elektronlarının sayısını belirleyin atomların her biri. Değerlik kabuğundaki elektronlar, atomun bağ oluşturmak için kullanabileceği elektronlardır.
- C. Lewis yapısını çıkar Her bir atomun değerlik kabuğunda kaç elektron olduğunu hesaba katarak.
Resim: Slayt Oynatıcı
Değerlik kabuğunun (RPECV) elektron çifti itme modeli.
İçinde Lewis yapıları bağlı atomların her biri, oktet kuralı. Bir atom oktet kuralını yerine getirdiğinde, bir atomun parçası olan elektron olabilen dört çift elektronla çevrilidir. bağ (bağ elektron çiftleri) veya bağ oluşumuna katılmayan elektron çiftleri (bağ yapmayan elektron çiftleri) bağlayıcı).
Göreceğimiz gibi, bir molekülün Lewis yapısı belirlendikten sonra, değerlik kabuğu elektron çiftlerinin itme modelini kullanan geometri çok kolay.
Bu temsil modeline göre, ligandlar (X) ve bağ yapmayan elektron çiftleri (E), merkez atomun (A) etrafında, aralarındaki mesafe maksimum olacak şekilde düzenlenir. Ligandların ve bağlanmayan elektron çiftlerinin (X + E) toplamı, molekülün geometrisinin tipini belirler.
X + E = 2
Doğrusal Geometri
AX2: Merkezi bir atoma bağlı iki ligand atomunun oluşturduğu molekül
Örnek: berilyum hidrit (BeH2).
X + E = 3
Üçgen düzlem geometrisi (eşkenar üçgen)
AX3: Bir merkezi atoma bağlı üç atomdan oluşan molekül
Örnekler: Bor veya alüminyum gibi bazı klorürler (BCl3, AlCl3)
Açısal geometri (120º açı)
AX2E: İki liganda bağlı bir merkezi atom ve bağlanmayan bir elektron çifti olan molekül.
Örnekler: Kalay (II) Klorür (Sn2Cl)
X + E = 4
dörtyüzlü geometri
AX4: Ligandlar birbirine bağlı olacak şekilde bağlar halinde düzenlenmiş dört ligandlı bir merkezi atoma sahip moleküller. karşı köşegenlerin köşelerinde merkezi atomun kendisi olan bir küp vardır.
Örnekler: Metan (CH4), silikon klorür (SiCl4) veya karbon tetraklorür (CCl4) gibi moleküller bu geometriyi sunar.
Üçgen Piramit Geometrisi
AX3E: Üç ligandın atomlarının oluşturulacak şekilde düzenlendiği 3 ligand ve 1 yalnız elektron çifti içeren moleküller merkezi atomun söz konusu piramidin üst köşesinde olduğu üçgen tabanlı bir piramidin tabanı piramit
Örnekler: Bu geometriye sahip moleküllerden biri amonyaktır (NH3).
Açısal geometri (109º açı)
AX2E2: İki ligand ve merkez atom, 109º'lik bir açı oluşturacak şekilde düzenlenmiştir.
Örnekler: Su (H2O) bu geometriye sahip moleküllerden biridir.
Gdoğrusal eometri
AX3: Merkez atoma bağlı sadece bir ligand olduğu için geometri doğrusaldır.
Örnek: Hidrojen Florür veya Hidroflorik Asit (HF).
X + E = 5
Üçgen bipiramidal geometri
AX5: Molekül, her ikisinde de ortak olan üçgen bir tabana sahip iki karşıt piramidin geometrisine sahiptir. Merkez atom merkezde düzenlenir ve ligandlar köşelerde bulunur.
Örnek: Fosfor pentaklorür (PCl5)
dishenoidal geometri
AX4E: Bu tür geometride atomlar, tahterevalli salıncak yapısına benzeyen bir düzen kazanır.
Örnek: Tetra kükürt florür (SF4).
T geometrisi
AX3E2: Moleküller, T harfine benzer, ligandlar mektubun uçlarında ve merkez atom onu oluşturan iki çizginin birleştiği noktada bulunur.
Örnek: Klor triflorür (ClF3)
Doğrusal geometri
AX2E3: Bu durumda, molekülün üç atomu, bir ara konumda merkezi atom ile aynı hizada düzenlenir.
Örnek: Ksenon Diflorür (F2Xe)
X + E = 6
oktahedral geometri
AX6: Bu molekül türü, merkez atomun geometrik şeklin merkezini ve köşelerinin her birinin altı ligandını işgal edeceği bir oktahedrona benzeyen bir yapıya sahiptir.
Örnek: Kükürt heksaflorür (SF6)
Kare tabanlı piramit
AX5E: Bu durumda, atomlar, merkez atomun tabanın merkezini işgal ettiği ve ligandların şeklin beş köşesini kapladığı bir şekil oluşturur.
Örnek: Brom Pentaflorür (BrF5)
Düzlem kare geometri
AX4E2: Atomlar, merkezi atomun şeklin merkezini işgal ettiği ve ligandların her bir köşesini kapladığı kare şeklinde bir düzenleme elde eder.
Örnek: Ksenon tetraflorür iyonu (XeF4)

Buna benzer daha fazla makale okumak istiyorsanız Moleküler Geometri: Tanım ve Örnekler, kategorimize girmenizi tavsiye ederiz. Atom.
bibliyografya
Alejandrina Gallego Picó, Rosa Mª Garcinuño Martínez, Mª José Morcillo Ortega, Miguel Ángel Vázquez Segura. (2018) temel kimya. Madrid: Birleşik