КЛАСИФІКАЦІЯ МЕТАЛІВ з періодичної системи

металів є більш рясні елементи на Періодична таблиця. Вони характеризуються: бути хорошими провідниками тепла та електрики, бути твердими при кімнатній температурі (з за винятком ртуті, яка є рідкою) і мають здатність відбивати світло, тому вони мають блиск характеристика.
Але цей великий набір елементів представлений упорядковано в періодичній системі в різних групах або сім’ях, що відображає їх подібність та відмінності. У цьому уроці від ВЧИТЕЛЯ ми побачимо, що класифікація металів та які характеристики та властивості різних груп визначені у цій класифікації.
Як ми вже згадували, метали є більшістю елементів Періодична таблиця. Вони розподіляються в двоє чудових хлопців які включають, у кожному випадку, різні підтипи, які згруповані в сімейства різних блоків періодичної таблиці.
Ось короткий опис цієї класифікації, який ми детальніше розробимо в наступних розділах.
- 1. Репрезентативні метали: s блок періодичної таблиці.
- 1.1. Сім'я лужні метали
- 1.2. Сім'я лужноземельні метали
- 2. Перехідні метали: блок d періодичної таблиці.
- 3. Внутрішні перехідні метали: блок f періодичної таблиці.
- 3.1. Лантаніди: елементи 6-го періоду таблиці.
- 3.2. Актиніди: елементи 7 періоду таблиці.
- 4. Постперехідні метали: p блок періодичної таблиці.
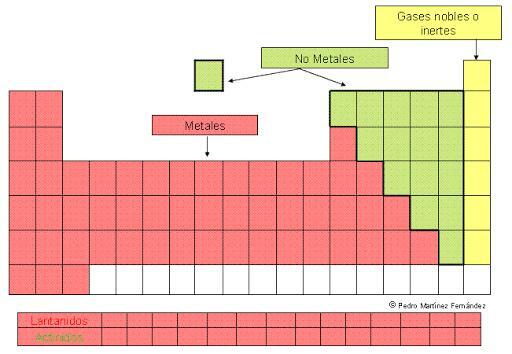
Зображення: Educamix
Репрезентативні елементи або основні елементи - це ті елементи, які є більше в природі. Серед металевих елементів репрезентативними елементами є метали блок s, тобто лужні елементи (сімейство 1 періодичної системи) та лужноземельні елементи (сім’я 2 періодичної системи).
У цих двох групах ми знаходимо дуже реакційноздатні елементи, що мають сильну тенденцію до окислення (втрачають електрони з валентної оболонки), отже, вони є потужними редукторами інших елементів. У природі вони містяться у вигляді іонних солей, добре розчинних у воді, оксидах або гідроксидах (сильних основах).
Лужні метали (група 1 періодичної системи)
- Лужні метали становлять 5% земної кори. Натрій (Na) і Калій (K) вони найпоширеніші.
- Вони є блискучі елементи сріблясті на вигляд, мають низьку щільність, є м’якими металами і мають високу реакційну здатність. Через їх високу реакційну здатність вони в природі не зустрічаються в чистому стані. Точки кипіння або випаровування лужних металів відносно низькі, і вони є хорошими провідниками тепла та електрики.
- З точки зору їх електронної конфігурації, вони є елементами, що представляють a одиночний електрон займаючи орбіталь своєї валентної оболонки. Вони мають потужність поєднання 1 (валентність) і число окислення +1. Вони демонструють велику тенденцію втрачати електрон із зовнішньої оболонки, утворюючи катіони.
- Як біоелементи, лужні метали розвиваються важливу роль у живих організмах, особливо натрій і калій, які відіграють фундаментальну роль у передачі нервів, а у випадку калію - у регулюванні активності ферментів.
- Ці метали мають багаторазове використання в промисловості. Наприклад, літій (Li) використовується для виробництва високоміцних алюмінієвих сплавів, у керамічному виробництві або як елементи батареї. Він також має медичне застосування, оскільки є складовою нервової системи, а його дефіцит викликає психічні захворювання.
Примітка: До групи 1 періодичної системи також входить Гідроген, який не є металом.
Лужноземельні метали (група 2 періодичної системи):
- Лужноземельні метали становлять 4% від складу земної кори. Їх особливо багато кальцій (Ca) і магній (Mg).
- Як і лужні метали, ці метали вони дуже реактивні тому в природі вони не зустрічаються у вільному вигляді.
- Хоча вони мають подібні фізико-хімічні характеристики з лужними металами, вони, як правило, є більш твердими та менш реактивними, ніж лужні метали. Вони мають низьку щільність а твердість і температура плавлення вищі, ніж у лужних металів.
- З точки зору електронної конфігурації, вони характеризуються представити орбіталу заповненої валентної оболонки (тобто зайняті парою електронів). Отже, вони мають потужність поєднання 2 (валентність) і число окислення +2. Вони легко реагують з галогенами (група 17 таблиці Менделєєва), утворюючи іонні солі.
- Ваша роль як складові живих організмів це особливо важливо у випадку кальцію (Са) та магнію (Mg). Іони магнію та кальцію є найбільш поширеними іонами морської води разом з хлоридним іоном (Cl-).
- 99% кальцію в нашому організмі міститься в скелеті, але в іонній формі відіграє фундаментальну роль у передачі нервів, нервово-м'язовій функції та регуляції ферментативні.
- Магній у своїй іонній формі виконує важливі біологічні функції в живих організмах, в тому числі Найвизначніша, його фундаментальна роль у фотосинтезі рослин як компонента хлорофіл.
- Промислове використання лужноземельних металів різноманітне. Найбільш актуальними є використання кальцію як компонента цементу, використання магнію для розробки пожеж штучний, як покриття залізних конструкцій для запобігання їх окисленню або як компонент сплавів і сталей світло.
Зображення: Сайти Google
У рамках класифікації металів ми повинні говорити про перехідні метали або метали Росії блок d, є найбільш поширеною групою металів і згруповані в всього 10 груп або сімей періодичної системи.
- Більшість перехідних металів мають характеристики, подібні до репрезентативних металів: вони хороші провідники тепла та електрики і відбивають світло.
- Вони демонструють велику мінливість щодо твердості та температур кипіння та плавлення, але, загалом, вони є твердіші і мають вищі температури плавлення і кипіння, ніж лужні метали та лужноземельні.
- Від хімічна точка зору вони характеризуються: маючи множинні координаційні числа (валентності) або ступені окиснення, вони, як правило, є хорошими каталізаторами (здатність збільшувати або зменшувати швидкість хімічних реакцій) і утворювати сполуки з кольором і мають здатність утворюють координаційні комплекси (хімічні сполуки з іоном металу в центрі, приєднані до ряду лігандів, розташованих у них навколо). З цієї причини перехідні метали утворюють катіони різних зарядів.
- Щільність дуже мінлива у цьому блоці елементів - від стронцію з низькою щільністю до осмію (Os), який є елементом з найбільшою щільністю в періодичній системі.
- Якщо ми подивимося на електронну конфігурацію перехідних металів, вони характеризуються поданням частково заповнені d орбіталі. Заповнення орбіталей у цьому блоці періодичної системи представляє ряд нерівностей, які відображаються у множинних числах окиснення, отриманих металами в цьому блоці таблиці періодичний.
Залізо (Fe) і титан (Ti): більш рясні перехідні метали
- Заліза найбільше і становить близько 5% ваги земної кори. Рідко можна зустріти його в елементарній формі в природі, де він зазвичай знаходиться з утворенням оксидів та карбонатів.
- Чисте залізо мало застосовується, але його сплави з іншими речовинами багаторазово використовуються. Корисними формами сплавів заліза є коване залізо (це сплав заліза, що характеризується низьким вмістом вуглецю та високим вмістом заліза. Він має таку властивість, що може бути формований до розжарення і твердне при швидкому охолодженні), чавун (який також відомий як назва сірого чавуну або чавуну, це сплав заліза, кремнію та вуглецю, що містить невелику кількість марганцю, фосфору та сірка; у яких вуглець має форму графіту) і сталь (очищений сплав заліза та вуглецю).
- Іншими перехідними металами, що широко використовуються в промисловості, є мідь та срібло. Крім того, багато перехідних металів використовуються в промисловості як каталізатори хімічних реакцій.
- На біологічному рівні залізо в його іонній формі відіграє фундаментальну роль у транспорт кисню, оскільки він є частиною активного центру гемоглобіну та міоглобіну.
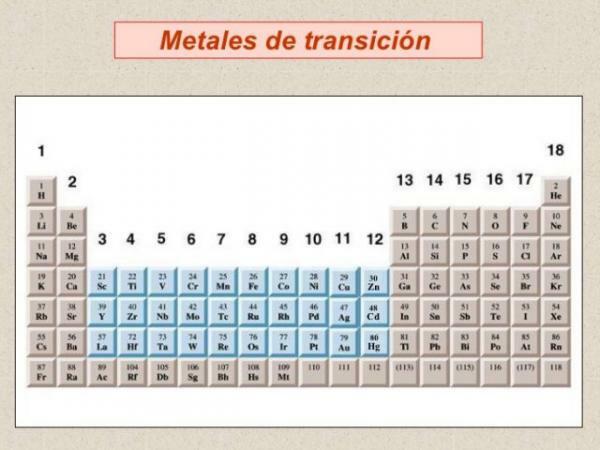
Зображення: сайт 100cia
Внутрішні перехідні метали або метали Росії блок fЇх ще називають рідкісноземельними. Вони згруповані в дві родини елементів: лантаніди та актиноїди. Це ті металеві елементи, в яких знаходяться електрони, що займають f-орбіталі. Елементи групи лантаноїдів частково зайняли ф орбіталі рівня 4, а актиноїди рівня 5.
Лантаніди або лантаноїди
- Вони є 15 елементами внутрішнього переходу які є частиною період 6 періодичної системи елементів.
- Ця група елементів має загальні характерні властивості. Є про м'які та блискучі сріблом метали, Його провідність тепла та електрики порівняно низька порівняно з іншими металами. Вони є металами меншої щільності, ніж перехідні.
- У природі вони зустрічаються в низьких пропорціях, утворюючи частину багатьох мінерали. Лантаніди мають високу здатність до намагнічування або намагнічування, а також характеризуються люмінесценцією їх катіонів.
- Лантаніди мають багаторазове використання в промисловості у виробництві міцних постійних магнітів, акумуляторних батарей та у виробництві надпровідних матеріалів. Вони мають багато застосувань в оптиці (виготовлення люмінесцентних ламп та ламп, рідкокристалічних дисплеїв та лазерів). Вони також використовуються як каталізатори хімічних реакцій або як пігменти.
Актиноїди або актиноїди
- Вони є 15 елементами що складають період 7 періодичної системи.
- Багато з них були штучно синтезовані, але вони також зустрічаються в природі в дуже малих пропорціях.
- Вони демонструють поведінку, подібну до поведінки перехідних металів (блок d) і відрізняється від поведінки лантанідів. Як і у випадку з багатьма металами, вони мають характерний сріблястий блиск.
- Як група, їх важливість полягає в тому, що вони всі радіоактивні елементи. Тобто це елементи, ядра яких нестійко розпадаються, виділяючи енергію (ядерну енергію) і породжують інші хімічні елементи з більш стабільним ядром. Усі ізотопи елементів цієї групи є радіоактивними та мають короткий період напіввиведення. Найбільш поширеними в природі актиноїдами є уран (U) та торій (Th).
Зображення: Slideshare