Частини атома та їх характеристика
Зображення: Answers.tips
Атоми - це основні елементи, які формують матерію, присутні у всіх станах речовини. Це дуже маленькі елементи, які неможливо побачити людським оком, але вони справді важливі для нашого Всесвіту. Щоб краще зрозуміти, як існують атоми і як вони працюють, на цьому уроці від ВЧИТЕЛЯ ми поговоримо частини атома та їх характеристики.
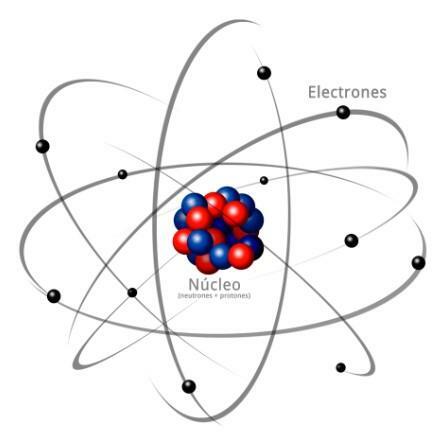
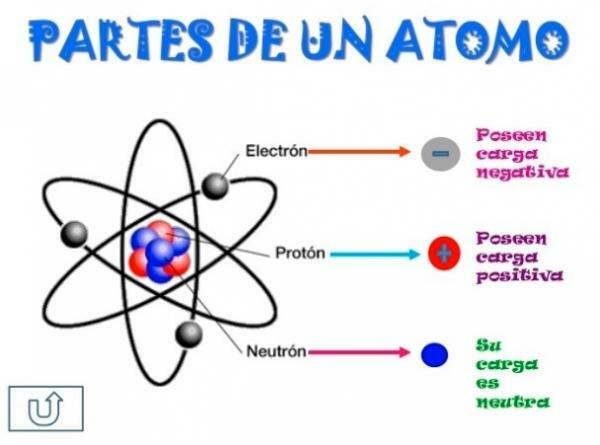
Всі атоми складаються з серцевина і кірка. Ядро, як вказує його назва, є центральною частиною атома, де знаходяться частинки, заряд яких позитивний і які називаються протони, а частинки, заряд яких нейтральний, тобто вони не мають електричного заряду, отримуючи назву нейтрони. Маса обох частинок, як протонів, так і нейтронів, однакова. Усі атоми одного і того ж хімічного елемента мають однакову кількість протонів, отримуючи це число, назва атомного номера, і використовуючи букву Z для його представлення.
З іншого боку є Кортекс що зовнішня частина атома. У корі ми знаходимо електрони, які є негативно зарядженими частинками. Електрони обертаються з великою швидкістю навколо ядра на різних рівнях, будучи частинками набагато меншими, ніж ті, що знаходяться в ядрі.
Будучи нейтральними нейтронами, позитивними протонами та негативними електронами, атом має нейтральний електричний заряд, оскільки вони мають таку ж кількість протонів, як і електрони. Хоча бувають випадки, коли електронів у меншій чи більшій кількості, ніж у протонів, що спричиняє заряд атом негативний або позитивний, в цьому випадку він отримує назву іон, аніон, якщо він негативний, або катіон, якщо він позитивний.
Зображення: Brainly
Щоб продовжити цей урок про частини атома та їх характеристики, ми повинні поговорити про еволюцію частин атома, оскільки атомна модель з часом змінювалась завдяки дослідженням вчених. Слід взяти до уваги, що декілька моделей, які ми збираємося пояснити, застаріли і не використовуються в даний час, але вони необхідні для розуміння еволюції наукової спільноти з цього питання.
Історична еволюція атомної моделі характеризується наступні вчені:
- Модель Dalton: Першою атомною моделлю стала робота Джона Далтона в 1803 році. Це дуже примітивна модель, в якій бракує багатьох елементів, таких як наявність електронів і протонів.
- Модель Томсона: Джону Томсону вдалося створити більш повну атомну модель, ніж модель Далтона, додавши кілька ключових елементів. Томсон виявив існування електронів і позитивних і негативних зарядів.
- Модель Nagaoka: Японський фізик Нагаока не погодився з моделлю Томсона, він вважав, що атом повинен мати велике позитивно заряджене ядро, на якому обертаються негативно заряджені електрони. Його теорію називають сатурніанською, оскільки він порівнював електрони з кільцями Сатурна. Багато разів ця модель не називається, але важливо розуміти великий крок, який робиться в цей час.
- Модель Резерфорда: Модель Резерфорда базувалася на існуванні позитивно зарядженого ядра, на якому оберталися негативно заряджені електрони. Ця модель дуже схожа на модель Нагаока, будучи дуже близькими роками, хоча японська модель і раніше.
- Модель Бора: Бор вважав, що електрони повинні бути відокремлені на великій відстані від шаруватого ядра, і кількість цих орбітальних частинок має бути рівним атомному номеру. Його модель також розуміє, що кількість електронів змінюється в кожній оболонці, у першій оболонці менше електронів, ніж у останній.
- Модель Шредінгера: Шредінгер порушив віру в те, що електрони - це крихітні частинки, які обертаються навколо ядра. Австрійський учений стверджував, що електрони рухаються за допомогою хвильової функції, тобто орбітальна форма.
- Модель Дірака: Дірак модифікував ідеї Шредінгера щодо своєї моделі, використовуючи "рівняння Дірака", щоб дати більш правильний вигляд орбітальної форми електронів.



