هيكل الذرة وخصائصها

الصورة: SlidePlayer
الذرات جزء من عالمنا. كل المواد مصنوعة من الذرات ، لذلك من المهم أن نفهم بشكل أفضل ما تتكون منها وما هي وظائفها. في هذا الدرس من المعلم سوف نخبرك ما هو هيكل الذرة وخصائصها. إذا كنت تريد معرفة المزيد عن الجسيمات التي يتكون منها كل شيء ، فاستمر في قراءة هذا المقال.
فهرس
- ما هي الذرات؟
- هيكل الذرة
- الخصائص الرئيسية للذرة
- ما هي النظائر؟
- كيف توجد الذرات في الطبيعة؟
ما هي الذرات؟
ال ذرة أنه أصغر وحدة يمكن تقسيم المادة إليها دون أن تفقد خصائصها الكيميائية ، أي خصائصها كعنصر كيميائي. الذرة هي أصل كل شيء يمكن رؤيته أو لمسه ، من النجوم إلى إفطارك هذا الصباح.
إذا وضعنا جانبًا فقدان خواصها الكيميائية ، يمكننا القول أن الذرة تتكون من جسيمات مختلفة تسمى الجسيمات دون الذرية. هناك ثلاثة أنواع من الجسيمات دون الذرية -البروتونات والنيوترونات والإلكترونات- بخصائص مختلفة.
يتم تجميع هذه الجسيمات بأرقام مختلفة لتكوين العناصر الكيميائية (الأكسجين والكربون وما إلى ذلك) ، ولكن سيتم دائمًا توزيعها باتباع بنية ثابتة.

الصورة: مواقع جوجل
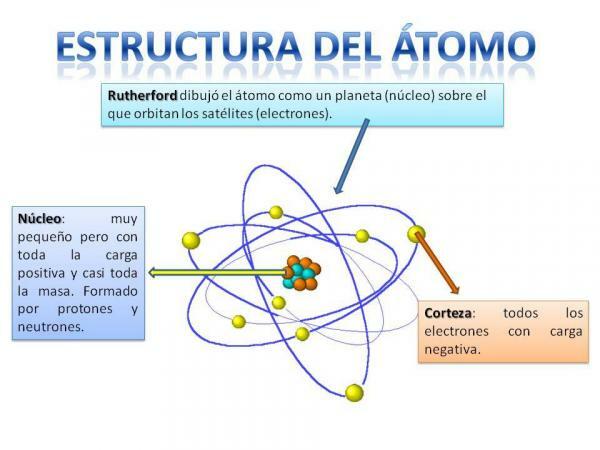
هيكل الذرة.
هيكل الذرة ثابتأي أنه يمكن أن يكون لدينا أنواع مختلفة من الذرات (ذرة الهيدروجين ، ذرة الأكسجين ، إلخ) ولكن جزيئاتها دون الذرية منظمة دائمًا بطريقة مماثلة لنظام الكواكب.
ستتذكر بالتأكيد كيف تم تنظيم النظام الشمسي: الشمس في المركز وحولها من هذا تدور الكواكب لتصف مدارات مختلفة ، بعضها أقرب والبعض الآخر بعيدًا عن شمس. في حالة الذرات ، يوجد في الوسط النواة، بشكل مشابه لبلاك بيري ويتكون من النيوترونات و ال البروتونات.
حول جوهر هو اللحاء وهي المنطقة التي من خلالها الإلكترونات. كان يُعتقد سابقًا أن الإلكترونات تصف مدارات معينة ، على غرار ما تفعله الكواكب ، على الرغم من أنها كذلك الآن يعلم أن هذه المدارات ليست محددة جيدًا وتشبه المناطق التي من المرجح أن نجد أنفسنا فيها الإلكترونات.
الصورة: REA - Plan Ceibal
الخصائص الرئيسية للذرة.
لمتابعة هذا الدرس حول بنية الذرة وخصائصها ، من المهم التركيز على العناصر التي تجعل الذرة تعتبر كذلك.
ولهذا علينا أن نجيب على هذا السؤال: لماذا تقرر كل الذرات ترتيب نفسها بهذه الطريقة المعينة؟ الجواب بسيط: إنه يرجع إلى قوى الجذب الكهربائية. تتكون نواة الذرة من نيوترونات ليس لها شحنة كهربائية والبروتونات التي لها شحنة كهربائية موجبة. والإلكترونات لها شحنة كهربائية سالبة ، لذلك هناك قوة جذب مماثلة بين النواة والإلكترونات أنتجت بين قطبي المغناطيس ولكنها ليست قوية بما يكفي "لسقوط" الإلكترونات في النواة.
يتم فهم هذا بشكل أفضل إذا أخذنا في الاعتبار حجم اللب: إذا كان للذرة ، على سبيل المثال ، أبعاد ملعب كرة قدم ، فإن النواة سيكون لها بعد الكرة في المركز من الملعب ، ما مقدار القوة الجذابة التي يجب أن تقدمها كرة القدم لسقوط مدرجات الاستاد عليها!
وظيفة النيوترونات
قد تتساءل الآن ، وما الدور الذي تلعبه النيوترونات؟ على الرغم من عدم وجود شحنة كهربائية للنيوترونات ، إلا أنها تلعب دورًا كبيرًا في الذرة: فهي تساهم بنسبة 99٪ من الكتلة. إذا كان ذلك يساعدك على التذكر ، فيمكننا القول إن الذرة تشبه عصابة من ثلاثة أصدقاء: الثقيل النيوترون ، البروتون الموجب والإلكترون السالب ، الذي يدور ويدور حول النيوترون و إلكترون.
حركة الإلكترونات
في هذه المرحلة ، أريد أن نعود إلى الشيء الذي تركناه في المحبرة: المدارات التي تصفها الإلكترونات حول النواة. قلنا ذلك تدور الإلكترونات حول النواة كما تفعل الكواكب حول الشمس ، بعضها أقرب من البعض الآخر ، لماذا يفعلون ذلك؟ تدور الإلكترونات في غلاف أو آخر وفقًا للطاقة التي يتعين عليها الابتعاد عن النواة ، أي أن تلك الإلكترونات الأقرب إلى النواة لا تمتلك قوة كافية للابتعاد عن النواة بينما تلك الموجودة في الطبقات الخارجية (المدارات) من القشرة لديها طاقة أكبر ويمكنها أن تتحرك بعيدًا عن النواة. النواة. علاوة على ذلك ، يوجد في كل من المدارات سعة قصوى تبلغ 8 إلكترونات (القاعدة الثماني).
جسيمات الذرة
سنعود إلى نهج آخر قمنا به سابقًا ولكننا لم نوضحه: تتكون الذرات من النيوترونات والبروتونات والإلكترونات، والتي تجمع دائمًا باتباع نفس بنية النواة والقشرة ، لكنها تفعل ذلك بأعداد مختلفة لتشكيل العناصر الكيميائية المختلفة. كيف يمكننا الحصول على هذه العناصر العديدة التي تجمع بين 3 أنواع فقط من الجسيمات؟ تتميز العناصر الكيميائية ، التي سبق لك أن رأيتها ممثلة في الجدول الدوري ، بوجود عدد ذري معين.
ال العدد الذري (Z) يخبرنا عدد البروتونات في نواة هذا النوع من الذرات ، والتي تساوي عدد الإلكترونات في الظروف العادية. وهكذا ، على سبيل المثال ، فإن جميع الذرات التي تحتوي على 6 بروتونات (Z = 6) ستكون ذرات كربون ، وستكون لها نفس الخصائص الكيميائية ؛ الذرات التي تحتوي على 5 بروتونات (Z = 5) ستكون ذرات بورون ، لها نفس الخصائص الكيميائية مثل بعضها البعض ومختلفة عن ذرات الكربون. ليس عليك الخلط بين العدد الذري والوزن الذري أو العدد الكتلي (أ)، وهو مجموع وزن النيوترونات والبروتونات (وزن الإلكترونات ضئيل بالنسبة لوزن النواة الكلية).

الصورة: SlidePlayer
ما هي النظائر؟
في الطبيعة يمكننا أن نجد "أنواع فرعية" مختلفة من العناصر ، و النظائر. أنا متأكد من أنك سمعت في وقت ما عن الكربون 14 ، وهو نظير مشع للكربون يستخدم لتحديد ، من بين أمور أخرى ، عمر الحفريات. النظائر ذرتان مع نفس عدد البروتونات (نفس العدد الذري) ، لكن عدد النيوترونات مختلف ، (كتلة ذرية مختلفة). عادة ما يتم تسمية نظائر نفس العنصر باسم العنصر متبوعًا بكتلته الذرية.
في مثالنا ، كلا النظيرين عبارة عن كربون ، لذا فلديهما عدد ذري من 6 (Z = 6) ولكن الكربون 12 (كربون عادي) له وزن ذري 12 مقابل الوزن الذري للكربون 14 14. تتمتع نظائر العنصر نفسه بخصائص كيميائية وفيزيائية متشابهة جدًا. في حالة الكربون 14 ، على عكس الكربون 12 ، فهو نظير مشع موجود في جميع العناصر التي تحتوي على الكربون ، بما في ذلك الكائنات الحية.
وبهذا ننهي هذا الدرس حول بنية الذرة وخصائصها. نأمل أن يكون قد ساعدك.

الصورة: المهام الخاصة بك
كيف توجد الذرات في الطبيعة؟
يمكن العثور على الذرات في عزلة ، ولكن الشيء الأكثر طبيعية هو العثور عليها مجتمعة في مجموعات اتصل الجزيئات.
يمكن أن تتكون الجزيئات من ذرات من نفس العنصر (مثل جزيء الأكسجين ، المكون من ذرتين من الأكسجين) أو مجموعات بها ذرات من عناصر مختلفة (ذرتان من الهيدروجين وواحدة من الأكسجين تشكل جزيء ماء). تسمى هذه المجموعات من العناصر الجزيئات ، والتي بدورها يمكن دمجها مع بعضها البعض و تشكيل مجموعات مختلفة أكثر وأكثر تعقيدًا وفقًا لتفاعلها وتقاربها الكيميائي مع مصدر روابط كيميائية.
إذا كنت ترغب في قراءة المزيد من المقالات المشابهة لـ هيكل الذرة وخصائصها، نوصيك بإدخال فئة الذرة.



