Objevte, jak je PERIODICKÁ TABULKA organizována SNADNO a PRAKTICKY

Obrázek: ptable.com
V roce 1869 vymyslel ruský chemik Dimitrij Ivanovič Mendělejev cestu klasifikovat všechny chemické prvky které se objevují v přírodě. Tato metoda klasifikace je periodická tabulka a mnozí ji popisují jako „srdce chemie“. Periodická tabulka se zrodila pouze s 63 chemickými prvky, ale jak byly objeveny, do jejích řad bylo přidáno mnoho chemických prvků.
V této lekci od UČITELE se podíváme jak je periodická tabulka organizována, vidět, jaká kritéria jsou dodržována při vkládání různých prvků do polí této tabulky.
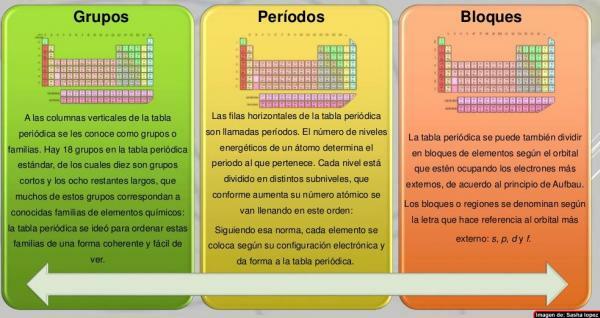
Na sloupce periodické tabulky byli nazýváni skupinami. V současné době je v periodické tabulce, která se běžně používá, tj. Standardní, 18 skupin, očíslovaných zleva doprava od 1 do 18. Tento způsob pojmenování skupiny (nomenklatura) se může lišit: někdy se používá smíšená nomenklatura římských číslic a písmen, při jiných příležitostech mají skupiny běžná jména (kovy alkálie, halogeny, ušlechtilé plyny atd.) a v jiných jsou pojmenovány jako „skupina ...“ a jméno jejího prvního člena (například „skupina skandia“ pro skupinu 3).
Mohou mít prvky stejné skupiny vzory různých vlastností:
- Atomový poloměr se zvyšuje, seshora dolů ve skupině. Jak sestupujeme v periodické tabulce, zvyšuje se počet elektronů a tím i počet nábojů jimi naplněných. Proto jsou elektrony v posledním plášti (valenčním plášti) dále od jádra a atomy jsou stále větší a větší, to znamená, že mají větší poloměr.
- Shora má každý prvek a nižší ionizační energie. Jelikož existuje více elektronů, jsou ty, které se nacházejí ve valenčním plášti, dále od jádra, a proto To je přitahuje menší silou, což usnadňuje odstraňování elektronů při sestupu. periodicky.
- Nakonec také pozorujeme a pokles elektronegativity ve stejné skupině. Opět platí, že jak se vzdálenost mezi valenčními elektrony a jádrem zvětšuje, elektrony ostatních atomů jsou dále od atraktivní síly jádra, a proto je přitahuje méně silně než menší atomy (skupiny vyšší).
Tyto zákonitosti jsou trendy, to znamená, že existují určité výjimky, například to, co se stane ve skupině 11, kde se elektronegativita dále zvyšuje ve skupině. Rovněž v některých částech periodické tabulky, jako jsou bloky d a f, nejsou horizontální podobnosti mezi prvky stejné skupiny tak označené.

Obrázek: Vědecká knihovna
Sedm vodorovných řádků periodické tabulky se nazývá období. Počet energetických úrovní atomu určuje období, do kterého patří. Každá úroveň je rozdělena do různých kategorií zvaných mušle nebo elektronické orbitaly, které mohou být typu s, p, d a f.
Jako to, co se stalo ve skupinách, položky ze stejného období mají podobné vzory atomový poloměr, ionizační energie, elektronová afinita a elektronegativita:
- V období, atomový poloměr normálně klesá, pokud se na periodické tabulce přesuneme doprava. Jak se pohybujeme od jednoho prvku k dalšímu, přidávají se protony a elektrony, což prvky způsobuje elektrony jsou vtaženy do jádra (nezapomeňte, že elektrony jsou pro přitažlivou sílu příliš lehké jádro).
- Snížení poloměru atomu ve stejném období způsobí ionizační energie a elektronegativita se zvyšuje zleva doprava, protože přitažlivost jádra na elektrony se zvyšuje.
- The Elektronická afinita také ukazuje průběh období, i když mírnější. Kovy, které jsou nalevo od periodické tabulky, mají obecně nižší afinitu než nekovy, které jsou napravo od období. Toto je obecnost a neplatí to pro vzácné plyny, které mají svou poslední vrstvu (valenční vrstvu) naplněnou, a proto jsou velmi málo reaktivní.
Obrázek: SlidePlayer
Prvky periodické tabulky lze rozdělit v blocích podle pořadí, ve kterém jsou dokončeny elektronové skořápky prvků. Každý blok je pojmenován podle nejnovějšíoběžná dráha, ve které je teoreticky poslední elektron (s, p, d nebo f):
- Blok s Skládá se z prvních dvou skupin, vodíku a helia.
- Blok str Skládá se z posledních šesti skupin (skupiny 13 až 18).
- Blok d Vytvářejí se skupiny 3 až 12 (běžně nazývané přechodné kovy).
- Blok f, který je obvykle umístěn samostatně, pod zbytkem periodické tabulky, nemá žádná čísla skupin a je tvořen lanthanidy a aktinidy.
Periodická tabulka prvků přežila tolik let, protože se jedná o systém, který se ukázal jako velmi užitečný a především proto, že jej lze aktualizovat. Teoreticky by mohlo existovat více prvků, které by vyplňovaly jiné orbitaly, ale tyto ještě nebyly syntetizovány nebo nebyly objeveny. V případě, že budou objeveny nové atomové prvky, budou vědci pokračovat v abecedním pořadí pojmenování různých bloků (blok g, blok h atd.).
Obrázek: Educando, portál dominikánského vzdělávání