Moellerův diagram: co to je, jak se používá v chemii a příklady
Chemie může být obzvláště komplikovaná, takže každý nástroj, který usnadní učení těm, kdo jsou s ní seznámeni, je vítán.
Jednou z nejpopulárnějších metod, jak se seznámit s Madelungovým pravidlem a elektronovou konfigurací atomů, je Moellerův diagram, grafické mnemotechnické pravidlo, díky kterému lze velmi snadno zjistit, ve kterých orbitálech je elektrony.
další zjistíme, z čeho se skládá Moellerův diagram, jak souvisí s Madelungovým pravidlem, jak je aplikováno pomocí několika řešených příkladů a které chemické prvky se této strategii neřídí.
- Související článek: "5 typů chemických vazeb: takto se skládá hmota"
Co je to Moellerův diagram?
Moellerův diagram, známý také jako metoda deště nebo pravidlo úhlopříček, je grafická a mnemotechnická metoda pro naučení Madelungova pravidla, technika pro poznání a zápis elektronické konfigurace chemických prvků.
Tento diagram je charakterizován kreslením diagonál přes sloupce orbitalů, shora dolů zprava doleva. Prostřednictvím Moellerova diagramu je definováno pořadí v plnění orbitalů, které bude definováno třemi kvantovými čísly: n, l a ml.
Moellerův diagram funguje následovně:

Každý sloupec odpovídá jinému orbitalu, kterým obíhají elektrony atomu, subatomární částice, které mají záporný náboj. Dotyčné orbitaly jsou: s, p, daf, každý se specifickým prostorem pro umístění elektronů, a proto s různými energetickými hladinami.
Pokud nakreslíme úhlopříčky nebo šipky ve výše uvedeném smyslu, máme první orbital 1s. Druhá šipka začíná na orbitálu 2s. Třetí šipka protíná 2p a 3s. Čtvrtá úhlopříčka je 3p a 4s. Pátá úhlopříčka je 3d, 4p a 5s a tak dále. Moellerův diagram je úvodní technikou pro ty, kteří začínají studovat elektronické konfigurace prvků periodické tabulky v chemii.
- Mohlo by vás zajímat: "6 hlavních odvětví přírodních věd"
Madelungovo pravidlo
Od Moellerova diagramu je grafické znázornění Madelungova pravidla (v některých zemích také známé jako Klechkovského pravidlo) musíme nejprve vědět, o co jde. Podle tohoto pravidla se plnění orbitalů atomu musí řídit následujícími dvěma pravidly:
Madelungovo první pravidlo
Nejprve jsou vyplněny orbitaly s nejnižšími hodnotami n + l, přičemž n je hlavní kvantové číslo a l je orbitální moment hybnosti..
Například 3d orbital odpovídá n = 3 a l = 2. Proto n + l = 3 + 2 = 5. Místo toho orbital 4s odpovídá n = 4 a l = 0, proto n + l = 4 + 0 = 4. Z toho vyplývá, že elektrony vyplňují nejprve orbital 4s před orbitálem 3d, protože 4s = 4, zatímco 3d = 5.
- Související článek: „11 typů chemických reakcí“
Madelungovo druhé pravidlo
Pokud mají dva orbitaly stejnou hodnotu n + l, elektrony nejprve obsadí ten s nižší hodnotou n.
Například 3d orbital má hodnotu n + l = 5, stejnou jako orbital 4p (4 + 1 = 5), ale protože 3d orbital má nejnižší hodnotu pro n, bude vyplněn jako první než 4p orbitální.
Ze všech těchto pozorování a pravidel lze dospět k následujícímu pořadí při vyplňování atomových orbitalů: 1s 2s 2p 3s 3p 4s 3d 4p. Toto pořadí je sice pevně dané, ale zapamatovat si jej nazpaměť je komplikované, proto existuje Moellerův diagram, který jeho pořadí graficky znázorňuje.
- Mohlo by vás zajímat: „9 postulátů Daltonovy atomové teorie“
Kroky, které je třeba dodržet při použití Moellerova diagramu
Jak jsme uvedli v předchozí části, Madelungovo pravidlo používá k určení čeho vzorec n + l orbitaly jsou vyplněny předtím a z toho určují, jaká je elektronická konfigurace prvku odhodlaný. To však již Moellerův diagram znázorňuje graficky a jednoduše, takže se stačí řídit sloupce stejného diagramu a nakreslete úhlopříčky, abyste zjistili, v jakém pořadí jsou orbitaly každého z nich živel.
Abychom objevili elektronovou konfiguraci atomu a ve kterých orbitálech se jeho elektrony nacházejí, musíme nejprve znát jeho atomové číslo Z. Číslo Z odpovídá počtu elektronů v atomu, pokud je tento atom neutrální, nebo co je totéž, že to není iont, ani kladný (kationt) ani záporný (anion).
Když tedy známe Z jako neutrální atom, již víme, kolik elektronů má neutrální atom tohoto prvku obvykle. S ohledem na to začneme kreslit úhlopříčky do Moellerova diagramu. Musíme vzít v úvahu, že každý typ orbitalu má jinou kapacitu pro uložení elektronů, což jsou:
- s = 2 elektrony
- p = 6 elektronů
- d = 10 elektronů
- f = 14 elektronů
Zastaví se na orbitalu, kde byl obsazen poslední elektron daný Z.
Příklady Moellerova diagramu
Pro lepší pochopení toho, jak funguje Moellerův diagram, níže uvidíme několik praktických příkladů nastavení elektronové konfigurace různých prvků.
Berylium
Abychom stanovili elektronovou konfiguraci neutrálního atomu berylia (Be), musíme jej nejprve vyhledat v periodické tabulce, alkalická zemina, která se nachází ve druhém sloupci a druhém řádku tabulky. Jeho atomové číslo je 4, tedy Z = 4 a má také 4 elektrony.
Vezmeme-li toto vše v úvahu, použijeme Moellerův diagram, abychom viděli, jak jsou umístěny 4 elektrony tohoto prvku. Začneme tím, že uděláme úhlopříčky ve výše uvedeném smyslu, shora dolů a zprava doleva.
Když plníme orbitály, Počet elektronů nalezených v každém z nich se doporučuje uvést jako horní index. Protože 1s je první orbital a zabírá dva elektrony, napíšeme to:

Protože máme stále volné elektrony, pokračujeme v zaplňování orbitalů. Další je orbital 2s a stejně jako u 1s zabírá 2 elektrony, tedy 2s2. Protože již máme všechny elektrony dobře umístěné v orbitalech neutrálního atomu Be, můžeme říci, že elektronová konfigurace tohoto prvku je:

Ujistíme se, že jsme udělali dobře, přidáním horních indexů: 2 + 2 = 4
- Mohlo by vás zajímat: "Molekulární kinetická teorie: 3 stavy hmoty"
Zápas
Prvek fosfor (P) je nekov, který se nachází ve třetím řádku a sloupci 16 periodické tabulky, se Z = 15, má tedy celkem 15 elektronů, které musí obsadit orbitaly.
Poté, co jsme viděli předchozí příklad, můžeme se trochu posunout vpřed a najít 4 jeho elektrony ve stejných orbitalech, jaké má berylium pro své 4 elektrony, chybí 9 elektronů Plus.

Po 2s orbitalu vstupuje další diagonála do 2p orbitalu a končí na 3s orbitalu. Orbital 2p může obsadit 6 elektronů a v případě 3s pouze 2. Měli bychom tedy:
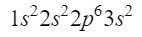
V tuto chvíli máme dobře umístěno 12 elektronů, ale zbývají nám ještě 3. Uděláme další úhlopříčku a tentokrát vstoupíme přes 3p orbital podle Moellerova diagramu, orbital, který má prostor pro 6 elektronů, ale protože nám zbývají pouze 3 elektrony, tento orbital nebude zcela obsazen, takže 3 jako horní index. Abychom ukončili fosfor, jeho elektronická konfigurace je následující:

Ujistíme se, že jsme udělali dobře, přidáním horních indexů: 2 + 2 + 6 + 2 + 3 = 15
Zirkonium
Prvek zirkonium (Zr) je přechodný kov nacházející se ve sloupci 4 a řádku 5 a má Z = 40. Zkrácením cesty s využitím předchozího příkladu můžeme lokalizovat prvních 18 elektronů.
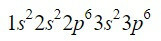
Po orbitalu 3p jsou další, které se zaplní, podle Moellerova diagramu, orbitaly 4s, 3d, 4p a 5s s kapacitou pro 2, 10, 6 a 2 elektrony.

Dokončením prvních devíti orbitalů v diagramu se přidá celkem 20 elektronů, ponechání 2 zbývajících elektronů, které jsou umístěny v dalším orbitalu, 4d. Elektronová konfigurace neutrálního prvku zirkonia je tedy:
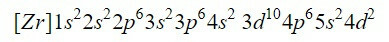
Ujistíme se, že jsme udělali dobře, přidáním horních indexů: 2 + 2 + 6 + 2 + 6 + 2 + 10 + 6 + 2 + 2 = 40
Kyslík
Zde vidíme trochu komplikovanější příklad, kterým je kyslík (O). Tento plyn se nachází ve sloupci 16 a řádku 2 periodické tabulky, je to nekov a má atomové číslo 8.
Při pohledu na další příklady bychom si zatím mysleli, že jeho Z = 8, ale není to tak jednoduché, protože tento plyn je zvláštní povahy, téměř vždy je ve formě iontu s nábojem -2.
To znamená, že i když neutrální atom kyslíku má 8 elektronů, jak naznačuje jeho atomové číslo, má Je pravda, že v přírodě má více, v jejím případě 10 (8 elektronů + 2 elektrony nebo chcete-li -8 nábojů elektrický -2).
Takže v tomto případě počet elektronů, které musíme v orbitalech lokalizovat, není 8, ale 10 elektronů, jako bychom lokalizovali elektrony chemického prvku neonu, který má Z = 10.
Když to pochopíme, musíme udělat totéž, co jsme dělali v předchozích případech, pouze s ohledem na to, že pracujeme s iontem (aniontem):
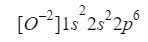
Ujistíme se, že jsme udělali dobře, přidáním horních indexů: 2 + 2 + 6 = 10
Vápník
Něco podobného jako kyslík se děje s vápníkem (Ca), jen v tomto případě mluvíme o kationtu, tedy iontu s kladným nábojem.
Tento prvek se nachází ve sloupci 2 řádku 4 periodické tabulky s atomovým číslem 20, avšak v Příroda je obvykle prezentována ve formě iontu s kladným nábojem +2, což znamená, že jeho elektronický náboj je 18 (- 20 + 2 = 18; 20 elektronů - 2 elektrony = 18 elektronů).
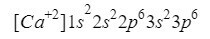
Ujistíme se, že jsme udělali dobře, přidáním horních indexů: 2 + 2 + 6 + 2 + 6 = 18
Výjimky z Moellerova diagramu a Madelungova pravidla
Ačkoli je Moellerův diagram velmi užitečný pro pochopení Madelungova pravidla a pro poznání, jak jsou umístěny elektrony různých chemických prvků, pravdou je, že není neomylný. Existují určité látky, jejichž složení není v souladu s tím, co jsme vysvětlili.
Jejich elektronové konfigurace se experimentálně liší od těch, které předpovědělo Madelungovo pravidlo z kvantových důvodů.. Mezi tyto prvky, které nevyhovují normám, máme: chrom (Cr, Z = 24), měď (Cu, Z = 29), stříbro (Ag, Z = 47), rhodium (Rh, Z = 45), cer ( Ce, Z = 58), niob (Nb; Z = 41), mimo jiné.
Velmi časté jsou výjimky při plnění orbitalů daf. Například v případě chrómu, který by měl mít valenční konfiguraci končící na 4s ^ 2 3d ^ 4 podle Moellerova diagramu a Madelungova pravidla, má ve skutečnosti valenční konfiguraci 4s ^ 1 3d ^ 5. Dalším zvláštním příkladem je stříbro, které místo 5s ^ 2 4d ^ 9 jako poslední má 5s ^ 1 4d ^ 10.

