Τι είναι οι ΧΗΜΙΚΕΣ ΦΟΡΜΟΥΛΕΣ και τι χρησιμεύουν [ΠΕΡΙΛΗΨΗ + ΒΙΝΤΕΟ]
Αν και δεν φαίνεται, τα χημικά στοιχεία του περιοδικού πίνακα Μας περικυκλώνουν από όλες τις πλευρές. Ωστόσο, πολλές φορές δεν βρίσκονται χωριστά, αλλά μάλλον σχηματίζουν μόρια ή μακρομόρια διαφόρων χημικών στοιχείων. Οι χημικοί τύποι είναι η γραφική έκφραση αυτών των ενώσεων και χρησιμοποιούνται για την τυποποίηση της ονοματολογίας τους. Σε αυτό το μάθημα από έναν ΔΑΣΚΑΛΟ θα δούμε τι είναι οι χημικοί τύποι και σε τι χρησιμεύουν. Ελάτε μαζί μας για να μάθετε περισσότερα!
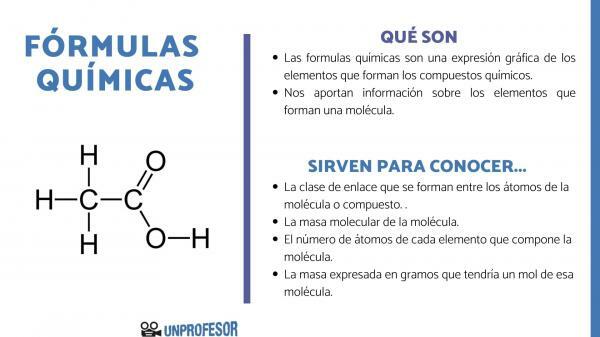
ο χημικούς τύπους είναι μια γραφική έκφραση των στοιχείων που απαρτίζουν το χημικές ενώσεις.
Αυτοί οι χημικοί τύποι δεν είναι αυθαίρετοι, αλλά ακολουθούν ορισμένους αυστηροί κανόνες της χημικής ονοματολογίας, που καθιερώθηκε από την IUPAC (International Union of Pure and Applied Chemistry).
Οι χημικοί τύποι μας παρέχουν επίσης πληροφορίες για το στοιχεία που συνθέτουν ένα μόριο, έτσι, για παράδειγμα, μας λέει τον αριθμό και τις αντίστοιχες αναλογίες καθενός από τα άτομα που το αποτελούν και, μερικές φορές, ακόμη και τον τύπο Χημικός δεσμός που υπάρχει ανάμεσα σε αυτά τα στοιχεία.
Κάθε μόριο ή μακρομόριο που υπάρχει αντιστοιχεί στον χημικό τύπο του, όπως κι αν υπάρχουν διαφορετικών τύπων τύπων. Καθένας από αυτούς τους τύπους μας δίνει διαφορετικές πληροφορίες για το μόριο, αλλά όλοι μας βοηθούν να το καταλάβουμε χημική φύση και μας βοηθά να κατανοήσουμε τι συμβαίνει στις χημικές αντιδράσεις και πώς μια ένωση μπορεί να μετατραπεί σε άλλες.
Αλλά για να κατανοήσουμε αυτή τη χημική ονοματολογία είναι απαραίτητο να έχουμε ορισμένες γνώσεις στη χημεία, καθώς υπακούουν σε μια αρκετά εξειδικευμένη τεχνική γλώσσα.

Εικόνα: Slideplayer
ο χημικούς τύπους αντιπροσωπεύονται από το ένωση χημικών συμβόλων, με το αντίστοιχο γράμμα κάθε ατόμου όπως μπαίνει στο Περιοδικός Πίνακας, και δείκτες, που είναι αριθμοί που αντιπροσωπεύουν το ποσό αυτών άτομα στο μόριο
Μέσα στη χημεία (τόσο οργανική όσο και ανόργανη) υπάρχουν ορισμένα θραύσματα ή ενώσεις που παρουσιάζουν κάποια υποτροπή τόσο δομική όσο και λειτουργική και προσδιορίζονται με ονόματα ειδικός. Όταν αυτά τα θραύσματα έχουν ελεύθερα ηλεκτρόνια που δεν είναι κοινά, ονομάζονται ρίζες και είναι ασταθείς, εξαιρετικά αντιδραστικές ενώσεις με σύντομο χρόνο ημιζωής.
Παραδείγματα ριζοσπαστών είναι ομάδες μεθυλίου CH3, νιτρικές ομάδες ΝΟ3, υδροξυλομάδες OH- ή η ρίζα Cl-. Ωστόσο, είναι γνωστές ως λειτουργικές ομάδες όταν είναι άτομα ή ομάδες ατόμων που συνδέονται σε μια αλυσίδα διοξείδιο του άνθρακα (με διάφορους άνθρακα) και τα οποία είναι υπεύθυνα για την αντιδραστικότητα και τις χημικές ιδιότητες των μόρια.
Αυτές οι ομάδες είναι ιδιαίτερα σημαντικές στην οργανική χημεία (τα ανθρώπινα βιομόρια είναι βασικά άνθρακας και υδρογόνο). Μερικά παραδείγματα λειτουργικών ομάδων είναι η καρβονυλική ομάδα = C = O ή την καρβοξυλική ομάδα -COOH.

Εικόνα: Monogramas.com
Όπως είπαμε, υπάρχουν διάφοροι τύποι χημικών τύπων. Καθένας από αυτούς τους τύπους μας δίνει έναν διαφορετικό τύπο πληροφοριών για τα μόρια και, ως εκ τούτου, εξυπηρετεί έναν συγκεκριμένο στόχο, χωρίς καμία φόρμουλα να είναι καλύτερη ή χειρότερη από κάποια άλλη γενικά.
Οι κατηγορίες χημικών τύπων που διακρίνουμε είναι:
Εμπειρικοί τύποι
Οι εμπειρικοί τύποι είναι οι απλούστεροι τύποι για να αναπαραστήσουν ένα χημικό μόριο, μερικές φορές λέγοντας ότι είναι ελάχιστοι τύποι. Αυτοί οι τύποι αντιπροσωπεύουν την αναλογία των ατόμων καθενός από τα στοιχεία του μορίου, τα οποία απλοποιούνται σε ακέραιους αριθμούς, πάντα τους μικρότερους. Ένα παράδειγμα αυτού του τύπου είναι το CH3 (μεθυλομάδα), με τρία άτομα υδρογόνου και ένα άτομο άνθρακα.
Ωστόσο, αυτοί οι τύποι μπορεί μερικές φορές να δώσουν εσφαλμένες αντιλήψεις σχετικά με τη σύνθεση του μορίου. Αυτό συμβαίνει όταν ο τύπος δεν υποδεικνύει τον πραγματικό αριθμό ατόμων στο μόριο, όπως με το υπεροξείδιο υδρογόνο, του οποίου ο εμπειρικός τύπος είναι HO όταν ο τύπος πρέπει να είναι H2O2 (δύο άτομα υδρογόνου και δύο από οξυγόνο). Αυτό συμβαίνει επομένως μέσω μιας σύμβασης ονοματολογίας, καθώς και οι δύο δείκτες είναι ίσοι, απλοποιούνται.
Ορισμένες ενώσεις, ωστόσο, μπορούν να αναπαρασταθούν μόνο με εμπειρικούς τύπους, καθώς αποτελούνται από δίκτυα ιόντων. Αυτό συμβαίνει για παράδειγμα στο κοινό άλας ή στο χλωριούχο νάτριο, το οποίο αντιπροσωπεύεται ως NaCl, το οποίο δείχνει ότι για κάθε νάτριο υπάρχει ένα χλώριο.
Μοριακοί τύποι
Αυτοί οι τύποι τύπων είναι αρκετά βασικοί, απλώς εκφράζουν τον τύπο των ατόμων και τον αριθμό του καθενός που υπάρχει σε ένα ομοιοπολικό μόριο. Είναι τύποι που παρουσιάζουν τα χημικά στοιχεία και τον αριθμό με γραμμικό τρόπο (με τη μορφή δείκτη. Ένα παράδειγμα αυτού του τύπου τύπου είναι όταν η γλυκόζη ονομάζεται C6H12O6, που εκφράζει αυτή τη γλυκόζη Το μόριο γλυκόζης αποτελείται από έξι άτομα άνθρακα, δώδεκα άτομα υδρογόνου και έξι από οξυγόνο.
Οι μοριακοί τύποι χρησιμοποιούνται ευρέως, μερικές φορές λέγοντας ότι είναι οι αληθινοί τύποι των μορίων. Σε πολλές περιπτώσεις, συμπίπτουν με τους εμπειρικούς τύπους, για παράδειγμα στο CO2.
Ημι-ανεπτυγμένες φόρμουλες
Οι ημι-ανεπτυγμένοι τύποι είναι ένα είδος τύπων παρόμοιο με τους μοριακούς τύπους, καθώς εκφράζουν επίσης τα άτομα που αποτελούν το μόριο και τον αριθμό τους, αλλά και παρέχουν πληροφορίες για τους χημικούς δεσμούς (που αντιπροσωπεύονται από γραμμές μεταξύ των ατόμων) και τον τύπο του δεσμού μεταξύ των ατόμων άνθρακα που τον σχηματίζουν (εάν είναι απλοί, διπλοί ή τριπλάσια). Ο ημι-ανεπτυγμένος τύπος είναι χρήσιμος για τον προσδιορισμό των ριζών που συνθέτουν το μόριο και τη χημική του δομή (οι δεσμοί μεταξύ των ατόμων άνθρακα και υδρογόνου δεν αντιπροσωπεύονται).
Στην περίπτωση της γλυκόζης, ο ημι-ανεπτυγμένος τύπος της είναι CH2OH - CHOH - CHOH - CHOH -CHOH - CHO και όπως φαίνεται τα άτομα άνθρακα, υδρογόνου και Το οξυγόνο είναι το ίδιο όπως στον μοριακό τύπο (έξι, δώδεκα και έξι, αντίστοιχα) και όλοι οι απλοί δεσμοί (η γλυκόζη έχει μόνο δεσμούς απλός). Αυτός ο τύπος είναι επομένως πιο σύνθετος τύπος από τον μοριακό τύπο.
Οι ημι-ανεπτυγμένοι τύποι ονομάζονται μερικές φορές συμπυκνωμένοι και είναι ίσως η πιο ευρέως χρησιμοποιούμενη κατηγορία τύπων. χρησιμοποιούνται, ιδιαίτερα στην οργανική χημεία, αν και δεν μας επιτρέπουν να παρατηρήσουμε την πραγματική γεωμετρία των μορίων.
Αναπτυγμένη φόρμουλα
Οι τύποι που έχουν αναπτυχθεί είναι λίγο πιο περίπλοκοι από τους ημι-ανεπτυγμένους. Σε αυτόν τον τύπο τύπων, ο δεσμός και η θέση κάθε ατόμου στο μόριο αντιπροσωπεύονται σε ένα καρτεσιανό επίπεδο, έως ότου αναπαρασταθεί ολόκληρη η ένωση.
Δομικός τύπος
Ο δομικός τύπος είναι μια γραφική αναπαράσταση της δομής του μορίου στο διάστημα, δίνοντάς μας πληροφορίες για τη σειρά και την κατανομή των ατόμων στο χώρο. Σε αυτόν τον τύπο, φαίνονται επίσης οι χημικοί δεσμοί που αποτελούν το μόριο και αν είναι απλοί, διπλοί ή τριπλοί. Αυτός ο τύπος είναι, επομένως, αυτός που μας δίνει τις περισσότερες πληροφορίες για το μόριο.
Αυτοί οι τύποι τύπων χρησιμοποιούνται περισσότερο σε επαγγελματικό επίπεδο στον κόσμο της χημείας, καθώς επιτρέπουν να δούμε πολύ πιο καθαρά τις χημικές αντιδράσεις ή τη σύνθεση νέων μορίων.
φόρμουλες Lewis
Πρόκειται για σύνθετους, πολύ συγκεκριμένους και τεχνικούς τύπους. Είναι επίσης γνωστά ως διαγράμματα ή δομές Lewis και είναι παρόμοια με τους αναπτυγμένους τύπους των μορίων, αλλά Επιπλέον, υποδεικνύονται τα ηλεκτρόνια που μοιράζονται τα άτομα σε κάθε χημικό δεσμό, τα οποία ποικίλλουν ανάλογα με το σθένος των ατόμων εμπλεγμένος.
Σε αυτούς τους τύπους, οι δεσμοί μεταξύ των ατόμων αντιπροσωπεύονται με γραμμές (που υποδεικνύουν επίσης εάν είναι απλοί, διπλοί ή τριπλοί) ή με ένα ζευγάρι κουκκίδων. Τα μεμονωμένα ηλεκτρόνια ή ηλεκτρόνια που δεν μοιράζονται στον δεσμό, αντιπροσωπεύονται από σημεία γύρω από το άτομο στο οποίο αντιστοιχεί.

Εικόνα: Οργανική Χημεία
Κατά τη σύνταξη τύπων, μερικές φορές γίνεται αναφορά στοαριθμός οξείδωσης του στοιχείου (είναι συχνό σε ιοντικές ενώσεις). Αυτά είναι ένα σύνολο θετικών και αρνητικών αριθμών που πηγαίνουν που σχετίζονται με κάθε στοιχείο.
- Οι αριθμοί οξείδωσης μπορούν να ερμηνευθούν ως οι αριθμός ηλεκτρονίων ότι ένα στοιχείο συμμετέχει σε έναν ομοιοπολικό δεσμό ή μεταφέρει σε έναν ιοντικό δεσμό.
- Όταν το σύμβολο οξείδωσης πάνω από το άτομο είναι αρνητικός, σημαίνει ότι αυτό το στοιχείο συλλαμβάνει ηλεκτρόνια και ο αριθμός που το συνοδεύει δίπλα του είναι ο αριθμός των ηλεκτρονίων που συλλαμβάνονται. Επομένως, μια κατάσταση οξείδωσης -1 σημαίνει ότι το στοιχείο παίρνει ένα ηλεκτρόνιο, -2 που παίρνει δύο, και ούτω καθεξής.
- Όταν το σημάδι της οξείδωσης είναι θετικός, το άτομο δίνει ένα ηλεκτρόνιο και ο αριθμός που συνοδεύει αυτό το σύμβολο είναι ο αριθμός των ηλεκτρονίων που δίνονται. Ομοίως, μια κατάσταση οξείδωσης +1 σημαίνει ότι αποδίδει ένα ηλεκτρόνιο, +2 ότι δίνει δύο κ.ο.κ.
Αυτό λειτουργεί κυρίως για ιοντικές ενώσεις, στους ομοιοπολικούς δεσμούς, αν και η ερμηνεία είναι παρόμοια, δεν είναι η ίδια αφού αυτοί οι δεσμοί μοιράζονται ηλεκτρόνια. Σε αυτές τις ενώσεις, μιλάμε για περισσότερα ηλεκτραρνητικά στοιχεία, τα οποία τραβούν περισσότερο από το ηλεκτρονικό ζεύγος και μένουν με ένα πιο αρνητικό φορτίο, ανάλογα με τον αριθμό των ηλεκτρονίων που προσελκύει. Αυτό μπορεί να φανεί στο φόρμουλες Lewis.
Αν θέλετε να μάθετε σε τι χρησιμεύουν οι χημικοί τύποι, πρέπει να λάβετε υπόψη ότι αυτός ο αριθμός μας επιτρέπει να λάβουμε μερικούς πληροφορίες μορίων, όπως είναι:
- ο κλάση συνδέσμου που σχηματίζονται μεταξύ των ατόμων του μορίου ή της ένωσης. Αυτοί οι δεσμοί είναι συνήθως ομοιοπολικοί όταν συμμετέχουν σε αυτόν μη μεταλλικά και ιοντικά άτομα, εάν είναι μεταλλικοί και μη μεταλλικοί δεσμοί.
- ο μοριακή μάζα του μορίου.
- ο αριθμός ατόμων κάθε στοιχείου που αποτελεί το μόριο. Μερικές φορές ονομάζεται εκατονταμερής σύνθεση του μορίου.
- Η μάζα που εκφράζεται σε γραμμάρια που θα είχε ένα μόριο από αυτό το μόριο.
Στην περίπτωση μιας ιοντικής ένωσης, για παράδειγμα χλωριούχου νατρίου ή κοινού άλατος, δεν είναι αυστηρά σωστό μιλάμε για μόρια (αν και μερικές φορές γίνεται), ότι αυτά τείνουν να σχηματίζουν μεγάλα συσσωματώματα και μακρομόρια. Σε αυτή την περίπτωση, ο τύπος της ένωσης μας βοηθά να δούμε ποια ιόντα τη σχηματίζουν και σε ποια ποσότητα.



