Milleks on PERIODILINE TABEL?
Perioodiline tabel on aatomielementide klassifitseerimissüsteem, mille leiutas Venemaa keemik 1869. aastal Dmitri Mendelejev ning hiljem reorganiseeriti ja uuendati teiste keemikute poolt kuni tema väljanägemiseni praegune. Vaatamata tööriistale, mis on osutunud kasulikuks kogu ajaloo vältel (seetõttu on seda jätkuvalt kasutatud ja ajakohastatud), on see a nii tüütu õppida ja mõista, mistõttu oleme kõik esitanud endale küsimuse "Milleks on tabel? perioodiline? ".
Kui soovite teada milleks on perioodiline tabel ja miks on oluline mõista selle omadusi, lugege seda õpetajat ikka edasi.
Indeks
- Perioodilise tabeli klassifikatsioon
- Leidke perioodilisustabeliga elemendi nimi või sümbol
- Tea elementi aatommassi
- Tea elementi aatomnumbrit
- Ennustada elemendi aatomi raadiust
- Võrrelge kahe elemendi ionisatsioonienergiat
- Keemilise elemendi elektronegatiivsuse leidmine
- Võrrelge kahe elemendi elektronide afiinsust
Perioodilise tabeli klassifikatsioon.
Nagu igas tabelis, on ka
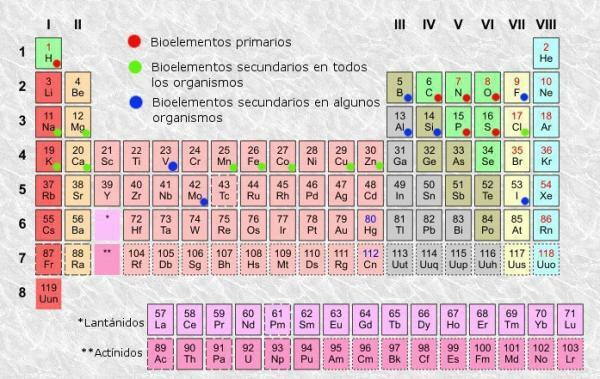
perioodilisustabel elementidest saame eristada veerge (vertikaalselt) ja ridu (horisontaalselt). Perioodilisustabelis on 18 veergu või rühma ja 7 rida või punkti.Lisaks saate kontrollida, kas tavaliselt kuvatakse tabeli igas ruudus vähemalt järgmine teave:
- Keemilise elemendi sümbol: lühendid või märgid, mida kasutatakse elementide tuvastamiseks. Need koosnevad tavaliselt ühest või kahest tähest, millest esimene on alati suurtähtedes.
- Keemilise elemendi nimi: ülemisele lühendile vastava keemilise elemendi nimi. Tavaliselt on see sümboli all.
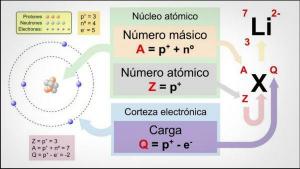
- Aatominumber: prootonite koguarv, mis selle elemendi igal aatomil on. Tavaliselt kuvatakse see üksuse kasti vasakus ülanurgas (või täielikumate tabelite paremas ülanurgas).
- Aatomimass: aatomi massi võib tavaliselt pidada prootonite ja neutronite kogu massiks ühes aatomis. See on saadaval lihtsaimate tabelite elemendi nime all, kuigi teistes võib see ilmuda elemendi kasti paremas ülanurgas.
On perioodilisi tabeleid, mis sisaldavad muud keerukamat ja spetsiifilisemat teavet, näiteks oksüdatsiooniastmed (kasulik näiteks keemiliste ühendite koostamisel), ionisatsioonienergia, elektronegatiivsus jne, kuid põhilised perioodilised tabelid anna piisavalt teavet ja tavaliselt piisab tavakasutajale, kes saab sealt teada sellist teavet, nagu me teile allpool ütleme.

Perioodilise tabeliga saate teada elemendi nime või sümboli.
Mõnikord teame keemilise elemendi sümbol aga me ei tea tema nime. Muul ajal teame keemilise elemendi nimi, kuid mitte selle lühendit ega sümbolit. Tegelikult on väga lihtne, et see sinuga klassis kunagi juhtus.
Nendel juhtudel saame kasutada perioodilist tabelit, ilma et oleks vaja keerukat, ning puuduvate andmetega tutvuda kiiresti ja täpselt.
Tea elementi aatommassi.
Mõnikord teame keemilist elementi, millega me tegeleme, kuid peame seda teadma aatommassehk kui palju selle elemendi aatom kaalub.
See teave on kasulik näiteks järgmiste ülesannete täitmisel:
- Arvutage aine konkreetne kogus.
- Analüüsige testides või katsetes saadud tulemusi.
- Arvutage massi protsent.
- Mõistke keerukate molekulide täpseid molaarmassid.
Tea elementi aatomnumbrit.
Aatomnumber on prootonite koguarv, mis elemendi aatomil on. Elektriliselt neutraalses aatomis, välja arvatud katioon (positiivselt laetud, ühe elektroniga vähem kui tavalises olekus) või aniooni (negatiivselt laetud, tavalisest olekust ühe suurema elektroniga), on prootonite arv võrdne elektronid.
Prootonite arv on otsustav tegur ühe elemendi eristamisel teisest, kuna elektronide või neutronite arv ei muuda elemendi tüüpi.

Ennustada elemendi aatomi raadiust.
Aatomraadius on pool sama elemendi kahe aatomi keskpunkti vahekaugusest, mis vaevu üksteist puudutavad. Sel juhul teadke keemilise elemendi asend perioodilisustabelis See võib aidata meil välja selgitada selle ligikaudne aatomiraadius või võrrelda seda mõne teise elemendiga. Selleks peame seda teadma aatomiraadius:
- See suureneb, kui liigume perioodilise tabeli ülevalt alla.
- See langeb, kui liigume perioodilisustabeli kaudu vasakult paremale.
Sel viisil on kaltsium väiksem kui rubiidium, kuid suurem kui raud.
Lisateave Mis on aatomi raadius selle teise videoõpetusega ÕPETAJALT.
Võrrelge kahe elemendi ionisatsioonienergiat.
The ionisatsioonienergia on energia, mis on vajalik elektroni eemaldamiseks elemendi aatomist. Sellisel juhul, kui teame kahe elemendi positsiooni perioodilisustabelis, võime teada, millist elementi on elektroni lihtsam "eemaldada". Peame ainult arvestama, et:
- Ionisatsioonienergia väheneb, kui see liigub perioodilisustabelis üles ja alla.
- Ionisatsioonienergia suureneb, kui liigute perioodilisustabeli vasakult paremale.
Berülliumi ja hapniku vahel on hapnikul rohkem ionisatsioonienergiat. Kui võrrelda hapnikku ja väävlit, mis on samas rühmas, kuid järgmisel perioodil, on hapnikul ka suurem ionisatsioonienergia, kuna see on perioodilisustabelis kõrgem.
Leidke keemilise elemendi elektronegatiivsus.
Elektronegatiivsus on aatomi võime elektronide ligimeelitamiseks. Praktikas tähendab see võimet moodustada keemiline side. Et teada saada, kas keemilisel elemendil on suur võime keemilise sideme moodustamiseks või mitte, peame arvestama ainult perioodilisustabelis järgitava mustriga:
- See laskub üles ja alla liikudes.
- See suureneb vasakult paremale liikudes.
Nagu ka eelmisel juhul, on hapnik elektronegatiivsem kui berüllium ja väävel, kuna see asub paremal kui esimene ja väävlist kõrgem.

Võrrelge kahe elemendi elektronide afiinsust.
The Elektrooniline afiinsus kas ta on energia muutus, mille neutraalne aatom elektroni ligitõmbamisel läbi teeb saada negatiivseks iooniks. Sel juhul ei erine elektrooniline afiinsus täpselt nii nagu eelmistel juhtudel, ehkki võime öelda, et üldiselt on elektrooniline afiinsus:
- See tõuseb samal perioodil vasakult paremale.
- Tõuse samas rühmas alt üles.
Kui soovite lugeda rohkem artikleid, mis on sarnased Milleks on perioodiline tabel?, soovitame sisestada meie kategooria Aatom.
Viited
Kas teil on sisendit või kommentaari perioodilisustabeli kasutamise kohta? Jätke see julgelt meie kommentaariumisse! Kas teile meeldis see artikkel? Võite oma hinnangu jätta ka allpool!