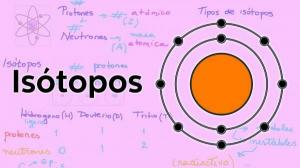
ISOTOOPIDE PÕHIOMADUSED

Pilt: planeedid
Kogu asi, millest meie planeet koosneb, koosneb aatomitest. Kuid kõik aatomid pole ühesugused, erinevate elementide aatomitel on erinev prootonite, neutronite ja elektronide arv. Mõnikord nende arv subatoomilised osakesed ei ole samad, ei ole tasakaalus ja sellised liigid nagu isotoopid. Isotoopid on sama elemendi aatomid (näiteks vesinik), kuid millel pole sama neutronite arv. See "tasakaalustamatus" põhjustab isotoopide omadused sama elemendi elemendid ei ole võrdsed. Selles ÕPETAJA tunnis vaatleme kõiki neid funktsioone üksikasjalikult. Me alustasime!
Indeks
- Mis on isotoop?
- Isotoopide aatomiomadused
- Isotoopide uudishimulik rakendus: isotoopmärgistus
- Sama elemendi isotoopide omadused
Mis on isotoop?
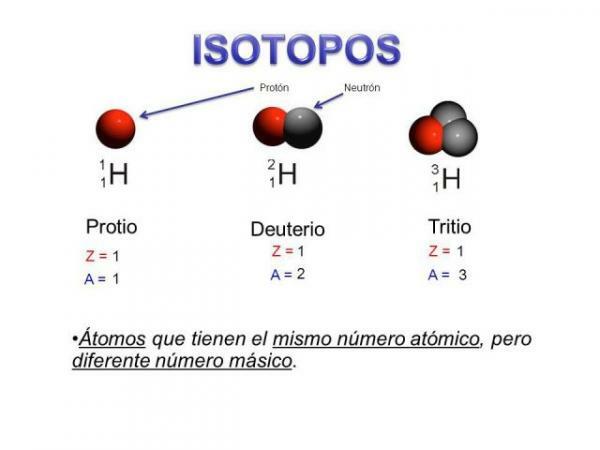
Enne isotoopide omadustest rääkimist on oluline paremini mõista, millest see koosneb. subatoomiline osake. Võiksime öelda, mis on isotoopid on aatomite "alamrühmad": Nemad on aatomid samast elemendist, kuid mis erinevad teatud asjades.
Isotoopid on
kaks aatomit sama arvu prootonitega (sama aatomnumber), kuid erinev neutronite arv (erinev aatommass). Sama elemendi isotoope nimetatakse tavaliselt elemendi nimega, millele järgneb selle aatommass. See on hästi tuntud jal süsiniku neliteist (C14), mida kasutatakse fossiilide vanuse määramiseks, kuid süsinikul on muid isotoope nagu süsinik 12 ja süsinik 13, mis on stabiilsemad kui muud süsiniku isotoopid nagu süsinik 8 või süsinik süsinik 22.Meie puhul on kõik need aatomid süsinikuaatomid, seega on nende aatomnumber 6 (Z = 6), kuid süsinik 12 (“Tavaline” süsinik) aatomimass on 12 süsiniku 14 aatomimassist või süsiniku aatomimassist 8 C8.
Need erinevused erinevate isotoopide vahel võivad põhjustada aatomite erinevaid omadusi, käitumist teiste elementide aatomitega, poolestusaegu jne.
Pilt: teie ülesanded
Isotoopide aatomiomadused.
- Isotoopide esimene omadus aatomi tasandil on see, et kõik isotoopid on sama elemendi aatomid.
- See põhiomadus viib meid teise tunnuseni: kõigil sama elemendi isotoopidel on sama aatomnumberehk sama palju prootoneid.
- Kõigil elemendi isotoopidel on sama palju prootoneid.
- Sama elemendi isotoopidel on erinev neutronite arv, see tähendab erinev massinumber või aatommass.

Pilt: EHU
Isotoopide uudishimulik rakendus: isotoopmärgistus.
Isotoopmärgistamine on meetod, mis kasutab isotoopide kahte väga olulist omadust: et kõik isotoopid reageerivad keemilised reaktsioonid ja mis mõnel neist on radioaktiivsus.
Keemilise reaktsiooni ajal võib kaks või enam ainet nimetatakse reaktiivideks, nad ühendavad oma aatomid ja moodustavad muid erinevaid aineid, mis tulenevad erinevatest kombinatsioonidest, nn tooted. The isotoopmärgistus on tehnika, mille abil saame reaktsiooni radioaktiivse isotoobi lisada reaktsiooni, nii et See reageerib normaalselt ja tänu radioaktiivsusele saame selle igal ajal üles leida kiirgama.
Selle tehnika muud variandid võimaldavad meil tuvastada reagendi erinevaid isotoope massispektromeetria või infrapunaspektroskoopia.

Pilt: Slideplayer
Sama elemendi isotoopide omadused.
Eelmises osas vaadeldud aatomiomaduste tagajärjel võivad sama elemendi isotoopidel olla muud tüüpi tunnused, mida kirjeldame allpool.
- Sama elemendi isotoopidel on erinev mass. Füüsikalised omadused nagu tihedus, mis on sama elemendi erinevate isotoopide jaoks erinev.
- Teatud keemilised omadused need sõltuvad elemendi tüübist, mis see on, ja seetõttu ei erine need elemendi erinevate isotoopide puhul. Näiteks on lahustuvusmis see saab olema pidev elemendi kõigi isotoopide jaoks.
- Isotoopide järgmine omadus on tihedalt seotud nende keemiliste omaduste võrdsusega: sama elemendi isotoopid reageerivad keemilistes reaktsioonides samamoodi. See tähendab, et kui süsiniku 12 aatom (kõige tavalisem või "tavaline" aatom) reageerib kahe hapniku aatomiga Süsinikdioksiidi molekuli moodustamiseks teame, et ka teiste süsiniku isotoopide omad on nad hakkavad. See on isotoopide ja radioisotoopide paljude praktiliste rakenduste jaoks väga oluline omadus.
- Elemendi isotoopid võivad olla looduslik või kunstlik päritolu. Kui kõnealust isotoopi leidub looduses, ilma et inimese käsi oleks selle loomisesse sekkunud, seisame silmitsi isotoopiga loomulik, kui aga see on loodud tuumareaktorites, osakeste kiirendites või radioisotoopide generaatorites, siis ütleme, et see on nii kunstlik. samal elemendil võivad olla looduslikud ja tehislikud isotoobid.
- Isotoope saab radioaktiivne või mitte-radioaktiivne. Radioaktiivsed isotoopid on need, milles on liiga palju energiat, mille aatom kipub kõrvaldama, et minna ebastabiilsest olekust suurema stabiilsusega.
- Seoses eelmiste omadustega võime öelda, et isotoopid radioaktiivne neil on a muutuv eluiga. Eluiga on aeg, mis kulub isotoobi lagunemisele, st selle ebastabiilseks muutva liigse energia lakkamisele. On radioaktiivseid isotoope, mis on väga ebastabiilsed ja nende eluiga on sekundid, teistel kulub lagunemiseks ja stabiilsemaks muutumiseks isikud või tunnid. Kunstlikult loodud aatomitel on tavaliselt palju lühem eluiga või lagunemisaeg kui looduslikel.
Kui soovite lugeda rohkem artikleid, mis on sarnased Isotoopide omadused, soovitame sisestada meie kategooria Aatom.
Bibliograafia
- Briceño V, G. (s.f) isotoopid.
- Belmonte, A. (15. mai 2019). Aatomi omadused.
- Vikipeedia (22. oktoober 2019). Isotoop.