Selvitä, missä elektronit ovat ATOMissa

Elektronit ovat subatomisia hiukkasia, jotka kiertävät atomiytimen ympärillä elektronipilvessä, jota kutsutaan elektroninen aivokuori. Tässä opettajalla opettaja näemme missä elektronit ovat atomirakenteen sisällä sekä elektronien käyttäytyminen atomien eri tiloissa (maa- ja kiihottumistila), kun atomit muodostuvat monatomiset ionit ja kun elektronit eivät ole sitoutuneet mihinkään tiettyyn atomiin.
Indeksi
- Mitä elektronit ovat ja mistä ne löytyvät?
- Kuinka tietää, mitkä ovat valenssielektronit?
- Atomin elektronit: perustila ja viritystila
- Elektronien vahvistus tai menetys: monatominen ionimuodostus
- Elektronit liikkeessä: sähkövirta
Mitä elektronit ovat ja mistä ne löytyvät?
elektronit Tiedän löytää sisältä n atomejajotka ovat pienimpiä aineita muodostavia yksiköitä. Atomit ovat jakamattomia, ja niiden rakenne ja koostumus määräävät materiaalien ominaisuudet.
Atomit koostuvat kolmesta tyypistä atomia pienemmät hiukkaset:
- Protonit: ovat hiukkasia, joilla on massa ja positiivinen varaus
- Neutronit: ovat hiukkasia, joiden massa ei ole sähkövarausta
- Elektronit: Ne ovat massattomia ja negatiivisesti varautuneita hiukkasia.
Protonit ja neutronit ovat osa atomin ydintä niin, että atomituuma se keskittää kaiken atomin massan ja positiivisen varauksen.
Elektronit puolestaan pyörivät ytimen ympäri määritellyillä kiertoradoilla muodostaen elektronipilven, jota kutsutaan elektroninen aivokuori. Atomin elektroninen kuori keskittää kaiken negatiivisen varauksen eikä sillä ole massaa.
Elektronien kiertoradat
Kiertoradat, joita elektronit kuvaavat atomiytimen ympärillä, ovat tietyt ennalta määritellyt kiertoradat. Eli elektronien polut atomiytimen ympärillä eivät ole satunnaisia. Elektronikuoren sisällä on vain muutama mahdollinen kiertorata elektronille; kun taas muut kiertoradat ovat kiellettyjä. on määritelty atomirata se alue ytimen ympärillä, jolla todennäköisyys löytää elektroni on yli 90%.
Jokaisessa näistä mahdollisista kiertoradoista sen läpi kiertävä elektroni saa tietyn energian, joka kasvaa, kun kiertoradat ovat kauempana ytimestä. Kiertoradat on ryhmitelty eri energian tasot (n) tai kerroksia, on yhteensä 7 energiatasoa, n = 1 on alin energiataso ja lähinnä atomin ydintä. Jokaisessa energiatasossa tai kerroksessa on erityyppisiä orbitaaleja (s, p, d ja f orbitaaleja)
Järjestely, jossa elektronit jakautuvat atomin eri energiatasoille ja kiertoradoille, tunnetaan nimellä elektroninen kokoonpano.

Kuva: Slideplayer
Kuinka tietää, mitkä ovat valenssielektronit?
Atomien fysikaaliset ja kemialliset ominaisuudet määritellään niiden koostumuksella ja erityisesti niiden elektronisella konfiguraatiolla uloin kerros (valenssikerros).
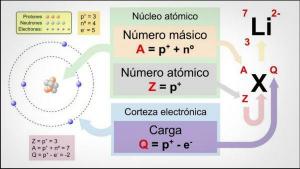
Kemialliset alkuaineet ovat olemassa olevia erityyppisiä atomeja, jotka määritellään niiden atomiluvun (Z) ja massanumeron (A) perusteella.
- Atomiluku (Z): atomielementin protonien määrä, joka on yhtä suuri kuin elektronien lukumäärä, jos atomi on neutraali.
- Massanumero (A): hiukkasten määrä, joilla on atomielementin massa, toisin sanoen atomiytimen hiukkasten summa (protonit plus neutronit).
Jokaiselle elementille annetaan a kemiallinen symboli joka edustaa sitä ja niiden kaikkien joukko lähetetään tieteellisessä asiakirjassa, jonka järjestykset niiden atomimäärän mukaan ja ryhmitellä ne ominaisuuksiensa mukaan affinien perheisiin ja ryhmiin: Jaksollinen järjestelmä.

Atomin elektronit: perustila ja viritystila.
vuonna perustila, joka määritellään seuraavasti: vähimmäisenergian ja maksimaalisen vakauden tila atomin; elektronit eivät ole jakautuneet satunnaisesti eri atomiorbitaaleihin, mutta ne vievät eri kiertoradat järjestäytyneesti, täyttämällä aina ensin pienimmät energiavapaat kiertoradat.
Tässä tilassa atomilla on sama määrä elektroneja kuin protoneilla ja positiiviset ja negatiiviset varaukset kompensoivat toisiaan, joten atomi kokonaisuutena on neutraali (sillä ei ole nettovarausta).
Elektronit kuitenkin voi hypätä yhdeltä kiertoradalta toiselle luovuttaa tai absorboida energiaa. Kun atomin elektronit eivät täytä orbitaaleja järjestetyllä tavalla, sanotaan atomin olevan innoissaan tila. Kiihtyvyystilassa yksi tai useampia elektroneja vie korkeamman energian kiertoradat jättäen tyhjiksi toiset pienemmästä energiasta. Viritetyssä tilassa atomit ovat erittäin epävakaita ja pyrkivät palaamaan nopeasti perustilaan.
Kun vaihdat kiertoradaa elektroni lähettää tai absorboi energiaa. Jos elektroni hyppää matalammalta kiertoradalta korkeammalle, atomi absorboi energiaa; kun taas hyppy tapahtuu vastakkaiseen suuntaan (korkeamman energian kiertoradalta pienemmälle), atomi vapauttaa energiaa.

Elektronien menetys tai vahvistus: monatomisten ionien muodostuminen.
Elektronisen kuoren (nimeltään valenssikuori) uloimmassa kuoressa olevat elektronit ovat elektroneja, jotka ne voivat jättää atomin tai ne voidaan sisällyttää tälle. Tällä tavalla atomi voi saada tai menettää elektroneja.
Jonkin sisällä neutraali atomi ytimessä olevien protonien lukumäärä on yhtä suuri kuin elektronien, jotka muodostavat sen elektronisen kuoren. Toisin sanoen positiivisten varausten määrä on yhtä suuri kuin negatiivisten varausten määrä. Kun on elektronien vahvistusta tai menetystä, atomit muodostuvat monatomiset ionit.
Monatomisten ionien tyypit
Ionin varauksen mukaan erotetaan kaksi tyyppiä:
- Monatomiset kationit: atomit, jotka ovat menettäneet yhden tai useamman elektronin, joten osa ytimen positiivisesta varauksesta ei kompensoidu. Siksi atomi saa positiivisen nettovarauksen.
- Monatomiset anionit: atomit, jotka ovat saaneet yhden tai useampia elektroneja siten, että elektronien määrä on suurempi kuin protonien lukumäärä ytimessä niin, että atomi saa negatiivisen nettovarauksen.

Elektronit liikkeessä: sähkövirta.
Kun elektronit ne eivät ole sidoksissa mihinkään atomiin erityisesti ne liikkuvat atomien välisen vapaan tilan läpi. Tämä itsenäinen elektronien liike muodostaa sähkövarauksen virran, joka voi kulkea tiettyjen materiaalien (johtavat ja puolijohteet) läpi.
Näin tapahtuu esimerkiksi sähkövirta joka toimittaa virtaa rakennuksiin, ajoneuvoihin jne.
Jos haluat lukea lisää artikkeleita, jotka ovat samanlaisia kuin Mistä elektronit löytyvät?, suosittelemme, että kirjoitat luokan Atomi.
Bibliografia
Alejandrina Gallego Picó, Rosa Mª Garcinuño Martínez, Mª José Morcillo Ortega, Miguel Ángel Vázquez Segura. (2018) Peruskemia. Madrid: Uned