Isotooppien pääominaisuudet

Kuva: Planeetat
Kaikki planeettamme muodostavat aineet koostuvat atomista. Mutta kaikki atomit eivät ole samat, eri alkuaineiden atomeilla on erilainen määrä protoneja, neutroneja ja elektroneja. Joskus näiden lukumäärä subatomiset hiukkaset eivät ole samat, eivät ole tasapainossa, ja sellaiset lajit kuin isotoopit. Isotoopit ovat saman elementin atomeja (esimerkiksi vety), mutta niillä ei ole yhtä monta neutronia. Tämä "epätasapaino" aiheuttaa isotooppien ominaisuudet saman elementin osat eivät ole yhtä suuria. Tässä OPETTAJAN oppitunnissa tarkastelemme kaikkia näitä ominaisuuksia yksityiskohtaisesti. Me aloitimme!
Indeksi
- Mikä on isotooppi?
- Isotooppien atomiominaisuudet
- Utelias isotooppien käyttö: isotooppimerkintä
- Saman alkuaineen isotooppien ominaisuudet
Mikä on isotooppi?
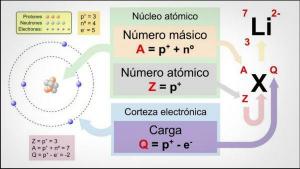
Ennen kuin puhutaan isotooppien ominaisuuksista, on tärkeää ymmärtää paremmin, mistä tämä koostuu. subatomiset hiukkaset. Voisimme sanoa, mitä isotoopit ovat atomien "alaryhmiä": He ovat atomeja saman elementin, mutta eroavat toisistaan tietyissä asioissa.
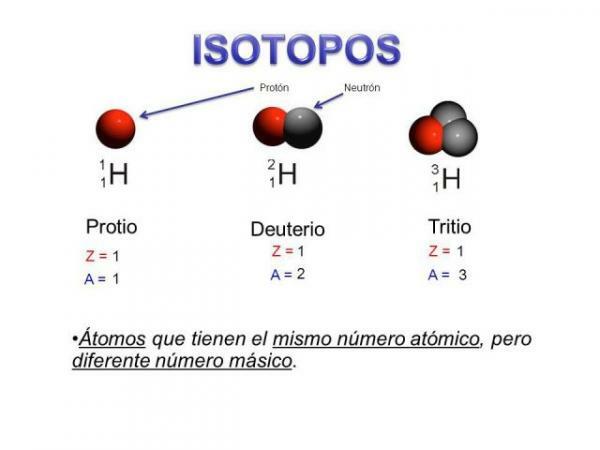
Isotoopit ovat kaksi atomia samalla protonimäärällä (sama atomiluku), mutta eri määrä neutroneja (erilainen atomimassa). Saman elementin isotoopit nimetään yleensä elementin nimen ja sen atomimassan kanssa. Se tunnetaan hyvin jal hiili neljätoista (C14), jota käytetään fossiilien iän määrittämiseen, mutta hiilellä on muita isotooppeja, kuten hiili 12 ja hiili 13, jotka ovat vakaampia kuin muut hiilen isotoopit, kuten hiili 8 tai hiili hiili 22.
Meidän tapauksessamme kaikki nämä atomit ovat hiiliatomeja, joten niiden atomiluku on 6 (Z = 6), mutta hiili 12 ("Normaali" hiili) atomipaino on 12 verrattuna hiilen 14 atomipainoon 14 tai hiilen atomipainoon 8 C8.
Nämä erot eri isotooppien välillä voivat aiheuttaa atomien erilaiset ominaisuudet, käyttäytymisen muiden elementtien atomien kanssa, puoliintumisajat jne.
Kuva: Tehtäväsi
Isotooppien atomiominaisuudet.
- Isotooppien ensimmäinen ominaisuus atomitasolla on, että kaikki isotoopit ovat saman elementin atomeja.
- Tämä pääominaisuus johtaa meidät toiseen ominaisuuteen: kaikilla saman elementin isotoopeilla on sama atominumero, eli sama määrä protoneja.
- Kaikilla elementin isotoopeilla on sama määrä protoneja.
- Saman elementin isotoopeilla on erilainen määrä neutroneja, ts. eri massanumero tai atomimassa.

Kuva: EHU
Utelias isotooppien käyttö: isotooppimerkintä.
Isotooppimerkinnät ovat tekniikka, jossa käytetään kahta isotooppien erittäin tärkeää ominaisuutta: että kaikki isotoopit reagoivat samalla tavalla kemialliset reaktiot ja että joillakin heistä on radioaktiivisuus.
Kemiallisen reaktion aikana kaksi tai useampia aineita, kutsutaan reagensseiksi, ne yhdistävät atominsa muodostaen muita erilaisia aineita, jotka johtuvat erilaisista yhdistelmistä, ns. isotooppimerkintä on tekniikka, jolla voimme lisätä reagenssin radioaktiivisen isotoopin reaktioon niin Tämä reagoi normaalilla tavalla, ja voimme löytää sen milloin tahansa sen radioaktiivisuuden ansiosta säteillä.
Tämän tekniikan muiden muunnelmien avulla voimme tunnistaa reagenssin eri isotoopit massaspektrometria tai infrapunaspektroskopia.

Kuva: Slideplayer
Saman alkuaineen isotooppien ominaisuudet.
Edellisessä osassa esitettyjen atomiominaisuuksien seurauksena saman elementin isotoopeilla voi olla muun tyyppisiä ominaisuuksia, jotka kuvataan jäljempänä.
- Saman elementin isotoopeilla on erilainen massa. Fysikaaliset ominaisuudet, kuten tiheys, joka on erilainen saman elementin eri isotoopeille.
- Varma kemialliset ominaisuudet ne riippuvat elementin tyypistä, joka se on, ja siksi ne eivät ole erilaisia elementin eri isotoopeilla. Esimerkki on liukoisuusmitä se tulee olemaan vakio kaikille elementin isotoopeille.
- Seuraava isotooppien ominaispiirre liittyy läheisesti niiden tasa-arvoon kemiallisissa ominaisuuksissa: saman alkuaineen isotoopit reagoivat samalla tavalla kemiallisissa reaktioissa. Tämä tarkoittaa sitä, että jos hiiliatomi 12 (yleisin tai "normaali" atomi) reagoi kahden happiatomin kanssa Hiilidioksidimolekyylin muodostamiseksi tiedämme, että myös muiden hiilen isotooppien he aikovat. Tämä on erittäin tärkeä ominaisuus monille isotooppien ja radioisotooppien käytännön sovelluksille.
- Elementin isotoopit voivat olla luonnollinen tai keinotekoinen alkuperä. Jos kyseinen isotooppi löytyy luonnosta, ilman ihmisen kättä puuttumassa sen luomiseen, kohtaamme isotoopin Luonnollinen taas, jos se on luotu ydinreaktoreissa, hiukkaskiihdyttimissä tai radioisotooppigeneraattoreissa, sanomme sen olevan keinotekoinen. samassa alkuaineessa voi olla luonnollisia ja keinotekoisia isotooppeja.
- Isotoopit voivat olla radioaktiivinen tai ei-radioaktiivinen. Radioaktiivisia isotooppeja ovat ne, joissa on liikaa energiaa, jonka atomilla on taipumus eliminoida siirtyminen epävakaasta tilasta stabiilimpaan tilaan.
- Aikaisempien ominaisuuksien suhteen voidaan sanoa, että isotoopit radioaktiivinen heillä on vaihteleva käyttöikä. Elinikä on aika, jonka isotooppi hajoaa, eli lopettaa ylimääräinen energia, joka tekee siitä epävakaan. On radioaktiivisia isotooppeja, jotka ovat hyvin epävakaita ja joiden käyttöikä on sekunteja, kun taas toisten hajoaminen ja muuttuminen vakaammiksi isotoopeiksi kestää tunteja tai jopa vuosia. Normaalisti keinotekoisesti luotujen atomien käyttöikä tai hajoamisaika on paljon lyhyempi kuin luonnollisilla.
Jos haluat lukea lisää artikkeleita, jotka ovat samanlaisia kuin Isotooppien ominaisuudet, suosittelemme, että kirjoitat luokan Atomi.
Bibliografia
- Briceño V, G. (s.f) Isotoopit.
- Belmonte, A. (15. toukokuuta 2019). Atomin ominaisuudet.
- Wikipedia (22. lokakuuta 2019). Isotooppi.