A quoi servent les ISOTOPES ?
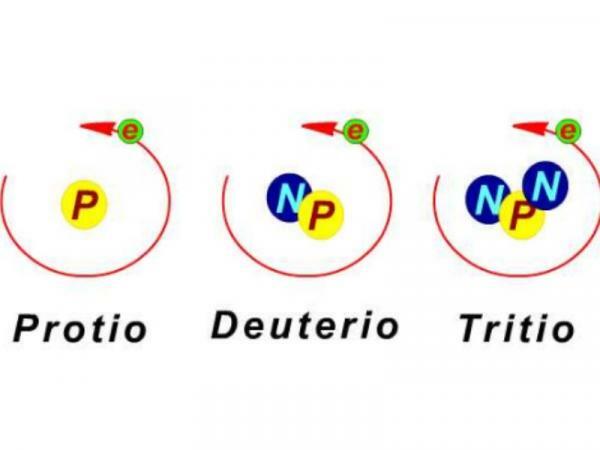
Les isotopes sont des atomes d'un même élément qui ont le même nombre de protons dans le noyau mais un nombre différent de neutrons. Cette différence qui, a priori, cela peut vous sembler assez insignifiant, cela rend les isotopes d'un même élément identiques ou différents dans de nombreuses caractéristiques et propriétés, physiques et chimiques. Les êtres humains ont pu profiter de chacun d'eux pour notre bien. Les applications des isotopes sont variées et touchent des domaines très différents: elles nous aident à conserver notre la nourriture, pour diagnostiquer et guérir des maladies ou pour découvrir l'âge des restes fossiles enfouis il y a des millions d'années. Dans cette leçon d'un ENSEIGNANT, nous verrons à quoi servent les isotopes et comment ils nous aident dans dix domaines différents de notre vie.
Indice
- Que sont les isotopes ?
- Isotopes et obtention d'énergie
- Isotopes en médecine
- Isotopes dans l'art et l'archéologie
- Isotopes dans l'alimentation et l'agriculture
- Autres applications des isotopes
Que sont les isotopes?
Les atomes Elles sont constituées, de manière classique, de trois types de particules: neutrons, protons et électrons. Les neutrons et les protons forment le noyau tandis que les électrons tournent autour du noyau, formant un "nuage d'électrons".
Les atomes d'un élément chimique sont caractérisés par un certain nombre de protons. Le nombre de protons d'un élément en chimie est appelé numéro atomique (Z). Les atomes sont électriquement neutres, c'est-à-dire qu'ils ont le même nombre total de particules positives (protons) que négatives (électrons). Une autre chose qui caractérise les atomes est leur nombre de masse (A) qui est la somme de tous les protons et neutrons qui composent le noyau atomique et qui lui donnent l'essentiel de son poids ou de sa masse. Vous pouvez en apprendre plus à ce sujet dans cette autre leçon d'un ENSEIGNANT sur Comment obtenir le nombre de masse?
Maintenant bien, deux atomes du même élément chimique (avec le même numéro atomique) peuvent avoir des nombres de neutrons différents dans leur noyau, et donc des poids atomiques différents. Ces deux atomes, de même numéro atomique mais de poids atomique différent, sont appelés isotopes. Isotopes du même élément chimique peuvent avoir des caractéristiques ou des propriétés qui les rendent très intéressants et utiles pour l'être humain. Si vous voulez en savoir plus sur le sujet, vous pouvez visiter notre leçon Caractéristiques des isotopes.
Maintenant que vous savez ce qu'ils sont, si vous vous êtes déjà demandé à quoi servent les isotopes, continue de lire!
Isotopes et obtention d'énergie.
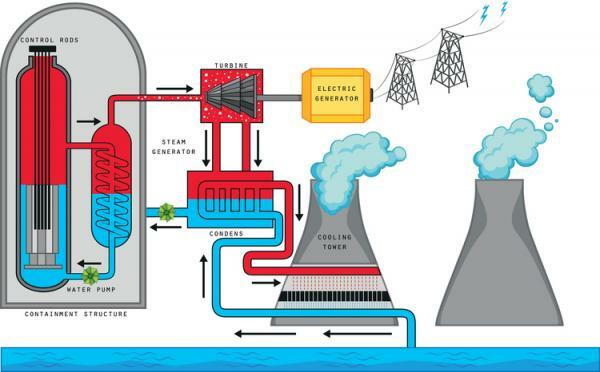
Comme vous le savez, l'une des principales sources d'énergie de la planète est l'énergie nucléaire. Le nom de l'énergie nucléaire vient du fait que l'énergie est obtenue, littéralement, à partir du noyau des atomes. Comme nous l'avons vu précédemment, le noyau des atomes est composé de protons et de neutrons, qui sont liés entre eux par une grande force. Cette énergie peut être libérée et utilisée par l'homme à travers deux processus: la fusion nucléaire (la combinaison de deux noyaux, qui se rejoignent pour former un plus grand et plus énergétique) et le Fision nucléaire (la désintégration ou la séparation d'un noyau en plusieurs plus petits).
Actuellement, la majeure partie de la production d'énergie nucléaire se fait par fission nucléaire. Pour cela, le Isotope du plutonium « Pu-239 » et isotope de l'uranium « U-235 » car ils sont très instables et lourds et la division du noyau entraîne une production d'énergie assez élevée. Lorsque les noyaux de ces isotopes se rompent, une grande quantité est générée sous forme de chaleur; Cette chaleur est utilisée dans les réacteurs nucléaires pour chauffer l'eau, qui passe de l'état liquide à l'état gazeux. Cette vapeur d'eau est transportée vers une turbine qui se déplace. À son tour, cette turbine est reliée à un générateur électrique dont la mission est de transformer l'énergie de rotation de la turbine en énergie électrique, qui peut être stockée, transportée et utilisée dans nos maisons.
Isotopes en médecine.
L'un des domaines dans lesquels l'application des isotopes est la plus importante est la médecine. On peut distinguer deux phases au cours de la maladie dans lesquelles les isotopes sont utilisés: le diagnostic et le traitement de la maladie.
Pour le diagnostic des maladies et des pathologies, des techniques telles que radiographies ou scintigraphie; les scanne reposent sur une méthode de détection radiopharmaceutiques, qui ne sont rien de plus que des mélanges de substances parmi lesquelles se trouvent de petites quantités d'un radio-isotope. Ils peuvent également être utilisés pour déterminer de petites quantités d'enzymes ou de protéines générées dans certains processus biologiques.
Les isotopes peuvent être utilisés pour traiter des maladies. Les isotopes sont utilisés pendant les traitements de radiothérapie détruire les cellules qui forment les tissus malins et les tumeurs; Dans ce processus, les rayonnements ionisants des équipements médicaux atteignent les cellules tumorales et affectent leur ADN, générant tellement de cassures et de mutations qu'elles provoquent leur mort. De plus, avant d'appliquer des traitements de radiothérapie, les isotopes peuvent aider les médecins à étudier les caractéristiques des cellules tumorales, leur localisation, etc. et ainsi créer un plan d'action pour ajuster la dose, la fréquence et le nombre de séances d'irradiation nécessaires avant de commencer le traitement.
Une autre application des isotopes en médecine est l'application des radio-isotopes pour la stérilisation du matériel, de l'équipement et des installations telles que les salles d'opération. Il existe différents types de stérilisation par rayonnement selon l'élément que nous utilisons, bien que le plus largement utilisé soit le rayonnement ultraviolet (UV).
Isotopes dans l'art et l'archéologie.
Si vous vous êtes déjà demandé à quoi servent les isotopes dans le monde de l'art et de l'archéologie, vous avez peut-être rencontré l'une de leurs applications: datation des œuvres. Les isotopes et la comparaison de la demi-vie de ceux-ci permettent de dater l'âge des échantillons des sites archéologiques issus de fouilles mais aussi d'œuvres d'art telles que des peintures, des peintures murales ou même des sculptures. Une autre des applications les plus pertinentes dans l'art est l'identification de contrefaçons ou altérations d'oeuvres: grâce à l'analyse isotopique il est possible de connaître non seulement la date à laquelle une œuvre a été réalisée (et détecter d'éventuelles copies) mais aussi de savoir quels sont les matériaux utilisé pour le faire (et les comparer avec ceux utilisés par l'auteur de l'œuvre supposée), vous pouvez enquêter sur les couches internes des œuvres sans les endommager, etc. Les micro-organismes et les insectes piégés dans les peintures humides peuvent même être détectés et leur âge analysé.
Enfin, les isotopes peuvent également être utilisés pour préserver les œuvres et éviter qu'elles ne soient endommagées. Certaines œuvres peuvent être recouvertes d'une substance sur laquelle un rayonnement gamma est ensuite appliqué. Cette combinaison de monomères et de rayonnement ralentit la détérioration de l'ouvrage puisqu'elle réduit la perte progressive de fixation qui le travail souffre lorsqu'il est exposé à l'environnement, il est stérilisé et les insectes, champignons et autres qui endommagent et contaminent le pièces. Cette méthode est généralement appliquée aux peintures mais il existe d'autres méthodes qui permettent de récupérer même des livres dans des conditions extrêmes de conservation.

Isotopes dans l'agriculture et l'alimentation.
L'agriculture et l'alimentation utilisent des isotopes à tous les niveaux, depuis avant que la plante ne soit plantée jusqu'à ce qu'elle atteigne notre table. Les isotopes sont utilisés pour l'amélioration génétique d'espèces végétales très importantes pour la consommation humaine, ce qui permet la développement de variétés génétiques plus productif, résistant et efficace. Une fois dans la plantation, les isotopes nous permettent une utilisation consciente des engrais puisqu'ils nous permettent de détecter leur surconsommation. Enfin, lors de leur préparation à la commercialisation, les isotopes sont utilisés lors de la stérilisation à la fois de contenants que le même produit lui-même, ce qui le fait durer plus longtemps et dans de meilleures conditions, jusqu'à ce qu'il soit consommation.
Autres applications des isotopes.
Il existe de nombreuses autres applications des isotopes, telles que les suivantes :
- Etude du cycle de l'eau. L'hydrologie utilise des isotopes pour suivre le cycle de l'eau et détecter une éventuelle contamination de l'eau au cours des différentes phases du cycle. L'une des applications les plus importantes est la détection de la contamination des eaux souterraines, en particulier de la surutilisation d'engrais.
- Études de pollution. Les isotopes ne sont pas seulement utilisés pour déterminer la contamination de l'eau comme nous l'avons vu au point précédent, mais ils peuvent être utilisés pour déterminer la présence de composés polluants soufrés et azotés dans l'atmosphère ou pour étudier la contamination des sédiments par des dérivés pétroliers pouvant provenir, par exemple, d'un déversement illégal.
- Applications des isotopes dans l'industrie. L'étude et la connaissance des propriétés des différents isotopes ont permis à l'industrie d'améliorer et de développer des procédés mais aussi de vérifier que différents instruments, pièces ou objets sont en parfait état (contrôle de qualité).
- Dans les mines et la cosmologie. Les isotopes sont utilisés pour créer des sondes nucléaires, chargées d'étudier la composition des différentes couches qui composent notre planète. En revanche, l'étude des isotopes qui contiennent météorites permet d'étudier l'âge de l'univers, l'origine possible de ces météorites et ses caractéristiques.
- Les isotopes et l'étude de l'espace extra-atmosphérique. Les isotopes sont utilisés pour fabriquer des cellules nucléaires; Ces appareils sont utilisés comme réserves d'énergie qui alimentent les équipements et les instruments des satellites et des sondes spatiales.
Si vous voulez lire plus d'articles similaires à A quoi servent les isotopes ?, nous vous recommandons d'entrer dans notre catégorie de L'atome.
Bibliographie
- Guerrero, R., & Berlanga, M. (2000). Isotopes stables: justification et applications. Société espagnole actuelle de microbiologie (29).
- Chaire Enresa-UCO (s.f) Utilisation de la radioactivité.



