10 प्रकार के रासायनिक तत्व (व्याख्या और वर्गीकृत)
ब्रह्मांड में कितने रासायनिक तत्व मौजूद होने चाहिए? इस प्रश्न को अभी भी एक लंबा रास्ता तय करना है, क्योंकि वैज्ञानिक समय-समय पर अपने स्वयं के कृत्रिम रासायनिक तत्व बना रहे हैं।
हालाँकि, हम जिसका उत्तर दे सकते हैं वह है कितने प्रकार के रासायनिक तत्व मौजूद होने चाहिए, कुछ ऐसा जो हम आगे जानेंगे।
- संबंधित लेख: "11 प्रकार की रासायनिक प्रतिक्रियाएं"
रासायनिक तत्वों के प्रकार
प्रकृति में हम सभी प्रकार के पदार्थ पा सकते हैं। ये पदार्थ आमतौर पर अपनी शुद्ध अवस्था में नहीं पाए जाते हैं, लेकिन विभिन्न के संयोजन का परिणाम होते हैं ऐसे तत्व या सामग्री जिन्होंने विभिन्न प्रतिक्रियाओं, प्रक्रियाओं और समय की अवधियों के माध्यम से सभी प्रकार के तत्वों को जन्म दिया है मामला। ब्रह्मांड में ऐसा कुछ भी नहीं है जो विभिन्न प्रकार के रासायनिक तत्वों से संबंधित परमाणुओं के संयोजन का परिणाम न हो, जिसे हम गहराई से देखेंगे।
हालांकि, रासायनिक तत्वों के प्रकारों को देखने से पहले आइए हाई स्कूल विज्ञान की थोड़ी समीक्षा करें और याद रखें कि रासायनिक तत्व क्या हैं।
हम "रासायनिक तत्व" पदार्थ कहते हैं जो एक ही प्रकार के परमाणु से बना होता है, अर्थात एक पदार्थ जो परमाणु रूप से शुद्ध होता है।
रासायनिक तत्वों को सरल में विघटित नहीं किया जा सकता है और उन्हें आवर्त सारणी में वर्गीकृत किया गया है तत्वों की ब्रह्मांड की शुद्ध सामग्री के रूप में।लेकिन खबरदार! हमें तत्वों को साधारण पदार्थों से भ्रमित नहीं करना चाहिए, क्योंकि कुछ मामलों में एक ही तत्व के दो या दो से अधिक परमाणु रचना कर सकते हैं अणुओं को अलग-अलग तरीकों से समूहीकृत किया जाता है, जिसके कारण तत्व के कुछ भौतिक गुणों में भिन्नता होती है, ये मामले हैं समस्थानिक उदाहरण के लिए, हीरा और कार्बन रासायनिक तत्व कार्बन (C) से बने पदार्थ हैं। लेकिन यह अलग-अलग तरीकों से व्यवस्थित होता है और इसके परिणामस्वरूप दो पूरी तरह से अलग सामग्री होती है।
कार्ल सैगन उन्होंने कहा कि हम सितारों पर प्रतिबिंबित करने वाले स्टारडस्ट हैं। यह खूबसूरत मुहावरा महज एक रूपक नहीं है, बल्कि एक वैज्ञानिक तथ्य है। जहां तक हम जानते हैं, रासायनिक तत्वों का निर्माण होता है, सितारों के अंदर जटिल का परिणाम होता है संलयन और परमाणु विखंडन प्रक्रियाएं जो तेजी से भारी तत्वों को उत्पन्न करती हैं, एक प्रक्रिया का परिणाम कहा जाता है न्यूक्लियोसिंथेसिस।
अधिकांश ज्ञात तत्व प्रकृति से प्राप्त किए जा सकते हैंयूरेनियम (यू), कार्बन (सी), सिलिकॉन (सी), चांदी (एजी) या सोना (एयू) जैसे अन्य तत्वों के साथ अनायास या यौगिक बनाते हुए पाए जाते हैं। दूसरी ओर, अन्य प्रयोगशालाओं में निर्मित किया गया है जैसे कि अमेरिकियम (एएम), बर्केलियम (बीके) या क्यूरियम (सीएम)। इसे प्राप्त करने का तरीका चाहे जो भी हो या यदि यह प्रकृति में मौजूद है, तो इसके गुणों के आधार पर, विचाराधीन रासायनिक तत्व के कुछ उपयोग या अन्य होंगे।
वर्तमान में लगभग 118 रासायनिक तत्व ज्ञात हैं, हालांकि यह ध्यान में रखते हुए कि मानव नए तत्वों का निर्माण करने में सक्षम है, यह आवर्त सारणी के विस्तार से पहले की बात है।
- आपकी रुचि हो सकती है: "दो प्रकार की बिजली (समझाया)"
रासायनिक तत्वों के मुख्य प्रकार
आवर्त सारणी में मुख्य प्रकार के रासायनिक तत्वों का प्रतिनिधित्व किया जाता है, एक प्रणाली रूसी रसायनज्ञ दिमित्री मेंडेलीव (1834-1907) द्वारा बनाया गया वर्गीकरण जिन्होंने इसकी नींव रखी थी 1869. रासायनिक तत्वों को उनके गुणों और विशेषताओं के आधार पर दृष्टिगत रूप से क्रमबद्ध किया जाता है।
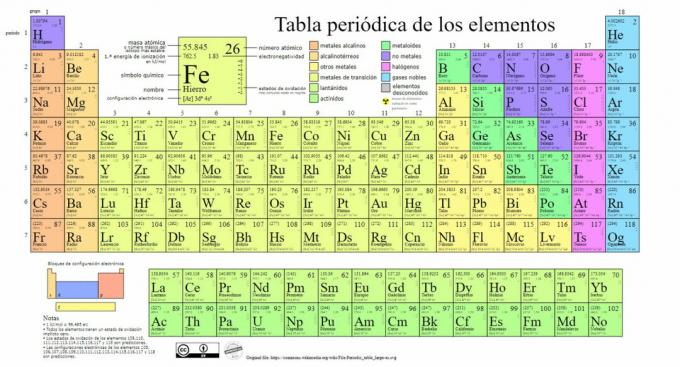
समय के साथ और जैसे-जैसे रसायन विज्ञान ने महत्वपूर्ण वैज्ञानिक खोजें कीं, इस तालिका का लगातार विस्तार होता जाएगा, अब तक ज्ञात 118 तत्वों के साथ आज के रूप में पहुंच गया है।
वर्तमान में, इस तालिका में हम निम्नलिखित प्रकार के रासायनिक तत्व पा सकते हैं:
1. धातुओं
धातु हैं रासायनिक तत्व जो आम तौर पर अपने परमाणु की अंतिम कक्षा में एक और तीन इलेक्ट्रॉनों के बीच होते हैं, इलेक्ट्रॉन जिन्हें आसानी से स्थानांतरित किया जा सकता है उन्हें ऊष्मा और विद्युत का सुचालक बनाते हैं।
धातुएं आमतौर पर निंदनीय और नमनीय होती हैं, जिनमें एक विशिष्ट चमक होती है, जिसकी तीव्रता उनके परमाणुओं को बनाने वाले इलेक्ट्रॉनों की गति पर निर्भर करती है। पारा को छोड़कर अधिकांश समय, धातु कमरे के तापमान पर ठोस होती है।
धातुओं में हमें सोना (Au), चांदी (Ag), तांबा (Cu) और एल्युमिनियम (Al) मिलता है, जिनकी भौतिक विशेषताएं उन्हें बिजली का शानदार संवाहक बनाती हैं।, हालांकि प्रकृति में उनकी उपस्थिति बहुत विविध है, उनके वजन के अंतर में परिलक्षित होती है।
ऐसा माना जाता है कि प्रकृति में मौजूद 75% रासायनिक तत्व धातु हैं, जबकि शेष 25% उत्कृष्ट गैसों, मेटलॉइड और अन्य प्रकारों से बने होंगे।
इस श्रेणी के भीतर वर्गीकरण हैं, एक्टिनाइड्स, लैंथेनाइड्स, संक्रमण धातु, क्षार धातु, क्षारीय पृथ्वी धातु और अन्य धातु खोज रहे हैं।
- संबंधित लेख: "जिंक में उच्च 10 खाद्य पदार्थ"
१.१. लैंथेनाइड्स
लैंथेनाइड तत्व कई खनिजों से बने निक्षेपों में पाए जाते हैं। वे सफेद धातुएं हैं जो हवा के संपर्क में आने पर आसानी से ऑक्सीकृत हो जाती हैं. उनमें से हम लैंथेनम (ला), प्रोमेथियम (पीएम), यूरोपियम (ईयू) और येटरबियम (वाईबी) पाते हैं।

- आपकी रुचि हो सकती है: "5 प्रकार के रासायनिक बंधन: इस तरह से बनता है पदार्थ"
१.२. एक्टिनाइड्स
एक्टिनाइड्स के सभी समस्थानिक रेडियोधर्मी होते हैं। उनमें से हम एक्टिनियम (एसी), यूरेनियम (यू), प्लूटोनियम (पु) और आइंस्टीनियम (एस) पाते हैं।
१.३. संक्रमण धातुओं
संक्रमण धातुएं आवर्त प्रणाली के मध्य भाग में स्थित होती हैं। इसकी मुख्य विशेषता यह है कि आंशिक रूप से इलेक्ट्रॉनों से भरा "डी" कक्षीय का इलेक्ट्रॉनिक विन्यास है.
इस समूह में सभी प्रकार के पदार्थ होते हैं और इसके व्यापक वर्गीकरण के अनुसार, यह रासायनिक तत्वों के अनुरूप होगा 21 से 30 तक, 39 से 48 तक, ७१ से ८० और १०३ से ११२ तक, कुल चालीस होने के नाते और उनमें से हम वैनेडियम (वी), रूथेनियम (आरयू), सिल्वर (एजी), टैंटलम (टा) और लॉरेन्सियो पाएंगे। (एलआर)।

१.४. क्षारीय धातु
क्षार धातु लिथियम (Li), सोडियम (Na), पोटेशियम (K), रूबिडियम (Rb), सीज़ियम (Cs) और फ़्रांशियम (Fr) से बने छह तत्वों का एक समूह है।. वे चमकदार, मुलायम धातुएं हैं, सामान्य तापमान और दबाव पर अत्यधिक प्रतिक्रियाशील हैं और अपने "एस" कक्षीय में स्थित अपने बाहरी इलेक्ट्रॉन को आसानी से खो देते हैं।
1.5. क्षारीय पृथ्वी
क्षारीय पृथ्वी धातु तत्वों का एक समूह है जिसमें हम बेरिलियम (बीई), मैग्नीशियम (एमजी), कैल्शियम (सीए), स्ट्रोंटियम (सीनियर), बेरियम (बीए) और रेडियम (आरए) पाते हैं। इसका नाम इसके ऑक्साइड, "पृथ्वी" को दिए गए नाम से आया है, जिसमें मूल या क्षारीय गुण होते हैं।
क्षारीय पृथ्वी वे क्षारीय से अधिक कठोर होते हैं, चमकते हैं और अच्छे विद्युत चालक होते हैं. वे क्षारीय की तुलना में कम प्रतिक्रियाशील होते हैं और अच्छे कम करने वाले एजेंटों के रूप में कार्य करते हैं। इनमें आयनिक यौगिक बनाने की क्षमता होती है और इन सभी के सबसे बाहरी कोश में दो इलेक्ट्रॉन होते हैं।

१.६. अन्य धातु
"अन्य धातु" श्रेणी है एक प्रकार के पदार्थ जो यहाँ पाए जाते हैं क्योंकि आप वास्तव में नहीं जानते कि उन्हें कहाँ रखा जाए.
वे धातु तत्व हैं जो पी ब्लॉक के भीतर आवर्त सारणी में मेटलॉइड के साथ स्थित हैं। वे कम गलनांक के साथ नरम होते हैं। इनमें एल्युमिनियम (Al), इंडियम (In), टिन (Sn) और बिस्मथ (Bi) शामिल हैं।

2. कोई धातु नहीं
अधातुओं में आम तौर पर अपनी अंतिम कक्षा में पांच से सात इलेक्ट्रॉन होते हैं, एक ऐसा गुण जो बनाता है कि वे उन्हें छोड़ने के बजाय इलेक्ट्रॉनों को प्राप्त करते हैं और इस प्रकार, उनके पास आठ इलेक्ट्रॉन होते हैं जो इस प्रकार उन्हें स्थिर करते हैं परमाणु।
यह तत्व वे गर्मी और बिजली के बहुत खराब संवाहक हैं. इसके अतिरिक्त, उनके पास एक विशिष्ट चमक नहीं है, वे बहुत निंदनीय नहीं हैं, बहुत नमनीय नहीं हैं और ठोस अवस्था में बहुत नाजुक हैं। धातुओं के विपरीत, उन्हें लुढ़का या बढ़ाया नहीं जा सकता है।
वे ज्यादातर जैविक प्रणालियों के लिए आवश्यक हैं, क्योंकि वे में मौजूद हैं कार्बनिक यौगिक, जैसे सल्फर (एस), कार्बन (सी), ऑक्सीजन (ओ), हाइड्रोजन (एच) और आयोडीन (आई)।

- संबंधित लेख: "20 प्रकार के कीमती पत्थर (वर्णित और चित्रों के साथ)"
3. Metalloids
जैसा कि उनके नाम से पता चलता है, मेटलॉइड हैं धातुओं और अधातुओं के बीच एक मध्यवर्ती वर्गीकरण जिसमें दोनों समूहों के गुण होते हैं. यह इस तथ्य के कारण है कि उनकी अंतिम कक्षा में चार परमाणु हैं, जो धातुओं और अधातुओं के बीच की मात्रा है।
ये रासायनिक तत्व केवल एक दिशा में बिजली का संचालन करते हैं, इसे विपरीत दिशा में करने की अनुमति नहीं देते हैं जैसा कि धातुओं में होता है। इसका एक उदाहरण सिलिकॉन (सी) में पाया जाता है, इस संपत्ति के लिए धन्यवाद, इलेक्ट्रॉनिक्स उद्योग के लिए अर्धचालक तत्वों के निर्माण में उपयोग किया जाने वाला धातु।
अन्य मेटलॉइड हैं: बोरॉन (बी), आर्सेनिक (एएस), सुरमा (एसबी) और पोलोनियम (पीओ)।

4. हैलोजन
हैलोजन छह तत्वों का एक समूह है जो वे दो परमाणुओं (डायटोमिक) से बने अणु बनाते हैं जो कि उनकी इलेक्ट्रोनगेटिविटी के कारण रासायनिक रूप से बहुत सक्रिय होते हैं.
ये पदार्थ आमतौर पर आयनों के रूप में प्रकट होते हैं, अर्थात विद्युत आवेशित अणु, जो इस मामले में मोनोनेगेटिव, अत्यधिक ऑक्सीकरण वाले होते हैं। इसका मतलब है कि हैलोजन कास्टिक और संक्षारक पदार्थ हैं।
हैलोजन हैं: फ्लोरीन (F), क्लोरीन (Cl), ब्रोमीन (Br), आयोडीन (I), एस्टेट (At) और टेनीज़ (Ts)।

5. उत्कृष्ट गैस
उत्कृष्ट गैसें सात का एक समूह है जिनकी प्राकृतिक अवस्था गैसीय होती है। वे आमतौर पर बहुत कम प्रतिक्रियाशीलता के डायटोमिक अणुओं के रूप में दिखाई देते हैं, अर्थात वे अन्य पदार्थों को बनाने वाले अन्य तत्वों के साथ प्रतिक्रिया नहीं करते हैं। और, इसी कारण से, उन्हें अक्रिय गैसों के रूप में जाना जाता है। ऐसा इसलिए है क्योंकि इसकी अंतिम कक्षा में उस स्तर के लिए इलेक्ट्रॉनों की अधिकतम संख्या संभव है, कुल आठ।
तत्वों का यह चुनिंदा समूह हीलियम (He), नियॉन (Ne), आर्गन (Ar), क्रिप्टन (Kr), क्सीनन (Xe), रेडॉन (Rn) और ओगेन्सन (Og) से बना है, जिसे पहले यूनुनोक्टियम के नाम से जाना जाता था।


