Evolucija PERIODIČNOG STOLA: od nastanka do danas
Periodni sustav jedan je od najznačajnije ikone znanosti. Iako je 2019. bila 150. godišnjica njenog stvaranja, to nikako nije gotov dokument. U ovoj ćemo lekciji od UČITELJA vidjeti što evolucija periodnog sustava od njegovog nastanka do danas i što je napredak u poznavanju atoma i njihovih svojstava omogućio.
Indeks
- Što je periodni sustav?
- Prva periodna tablica: podrijetlo
- Povijest periodnog sustava i evolucija
Što je periodni sustav?
The periodni sustav elemenata Periodični sustav elemenata znanstveni je dokument koji koncentrira više informacija u manje prostora i predstavlja jednu od najmoćnijih ikona znanosti. Sadrži dobar dio znanje koje imamo o kemiji. Ne postoji sličan dokument ni u jednoj drugoj znanstvenoj disciplini.
Periodni sustav elemenata je a sustav klasifikacije kemijskih elemenata Počelo je prije više od 200 godina. Ovaj je klasifikacijski sustav s vremenom rastao i mijenjao se kako je znanost napredovala i otkrivani novi
kemijski elementi. Međutim, ugrađene su razne modifikacije zadržavajući temeljnu strukturu netaknutom.Periodni sustav je tako nazvan jer izražava grafički način na koji ponavljaju u pravilnim intervalima određeni kemijska svojstva. To je vrsta dvodimenzionalnog prikaza ili, u svojim modernijim prikazima, trodimenzionalnog.
U klasični periodni sustav (dvodimenzionalan) kemijski su elementi raspoređeni u grupe ili obitelji a predstavljeni su u trenutnom periodnom sustavu u vertikalnim stupcima. Uređeni raspored ovih skupina u stupcima dovodi do niza redova, koji se nazivaju razdobljima, gdje su elementi poredani prema svojoj atomskoj težini. Periodni sustav sastoji se od sedam razdoblja koja se razlikuju u duljini.

Prva periodna tablica: podrijetlo.
Prije Mendelejeva, drugi su znanstvenici razvili sustave klasifikacije kemijskih elemenata. Ali, za razliku od periodnog sustava elemenata, jesu puki popisi poznatih elemenata; dok periodni sustav ima posebnost što je klasifikacijski sustav u dvije dimenzije (redovi i stupci) ili tri dimenzije, u najmodernijim inačicama, gdje su kemijski elementi poredani sukcesivno slojevi.
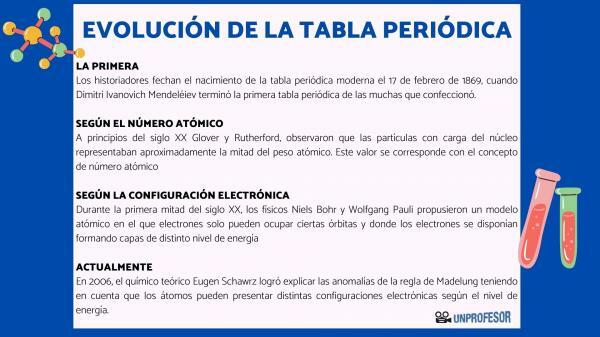
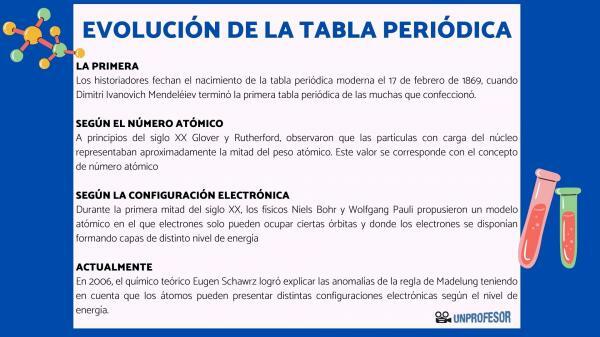
Iz tog razloga povjesničari datiraju rođenje modernog periodnog sustava 17. veljače 1869, kada Dimitri Ivanovič Mendelejev dovršiti prvi periodni sustav od mnogih koje je stvorio. Ova se tablica sastojala od 63 elementa raspoređenih u obitelji i ostavljala prazna mjesta za elemente koji još nisu otkrio, ali iz kojeg je izveo njihovu atomsku težinu (kao u slučaju Galija, Germanija i Skandij)
Ključni podaci za otkriće periodnog sustava bili su dosadašnja saznanja o atomska težina svakog elementa.
Što je atomska težina i atomski broj?
Ovaj broj predstavljala težinu atoma i to je bila jedina mjerljiva vrijednost atoma. Ali to nije bilo ni u jednom slučaju izravnih mjerenja (ne postoje mjerni uređaji koji omogućuju vaganje izoliranih atoma), već su to bili sustav koji je uspostavio standard u kojem je atomu vodika dana proizvoljna vrijednost 1, a u odnosu na to izračunata je vrijednost atomske težine preostalih elemenata Uzorak.
Prvi izračuni atomski broj elemenata izveo je engleski kemičar John Dalton, i iznjedrio veliku znanstvenu raspravu tijekom prve polovice 19. stoljeća. Međutim, u drugoj polovici 19. stoljeća već je postojao izvanredan konsenzus o sustavu izračunavanja atomskih težina elemenata. Atomska težina postala je od Mendelejeva nadalje, ključni kriterij za točan poredak elemenata u periodnom sustavu.
Kad je Mendeleev naredio poznate elemente prema njihovim povećanje atomske težine, uočio je pojavu ponavljajućih svojstava koja su omogućila da se elementi grupiraju u skupine ili obitelji elemenata koji su međusobno slični. Međutim, u nekim slučajevima poredak elemenata prema njihovoj atomskoj težini nije odgovorio na sličnosti između elemenata koji su uočeni i Mendeleev se promijenio položaj 17 elemenata u rasporedu periodnog sustava unatoč njihovoj atomskoj težini, kako bi ih se moglo grupirati s onim elementima s kojima su prikazali analogije.
Te su promjene pokazale da neke od prihvaćenih atomskih težina nisu točne i da su preračunate. Unatoč korekcijama atomskih težina, još uvijek je bilo elemenata koji su morali biti postavljeni na položaje koji nisu oni koji su označeni njihovim atomskim težinama.

Slika: BBC.com
Povijest periodnog sustava i evolucija.
Unatoč nedvojbenom doprinosu Mendelejeva, periodni sustav elemenata nije rezultat rada niti jednog istraživača. Pored Mendelejeva, tijekom druge polovice devetnaestog stoljeća i tijekom dvadesetog stoljeća mnogi Kemičari su nastavili istraživati najbolji način organiziranja informacija o kemijskim elementima znan. Još više s obzirom na to da je u to vrijeme otkriće novi kemijski elementi ili jednostavne tvari, zahvaljujući spektrometriji (koja proučava interakcije između atoma i elektromagnetskog zračenja).
The klasifikacija elemenata u periodnom sustavu u početku se temeljio na početnim izračunima atomske težine elemenata i otkrio analogije koje su omogućile da se elementi grupiraju u analogne obitelji. Bez obzira na to, razlog pojave tih periodičnih svojstava nije se mogao objasniti. Bilo je to tijekom 20. stoljeća, otkrićem elektroničke strukture, kada se shvatio razlog ove periodičnosti u svojstvima elemenata.
Atomski broj kao poredak
Početkom 20. stoljeća Glover i Rutherford, primijetio je da nabijene čestice u jezgri čine oko polovice atomske težine. Ova vrijednost odgovara konceptu atomski broj koji je definiran kao broj protona u atomskoj jezgri i koji se podudara s brojem elektrona u neutralnom atomu. Ta je nova vrijednost opravdala promjene položaja nekih elemenata koje su do tada provedene. Na primjer promjena položaja između telurja i joda.
1913. god. Henry Moseley potvrdio je poredak tablice u funkciji atomskog broja rentgenskom spektrometrijom. Poredak prema atomskom broju i danas je na snazi.
Istodobno, tijekom 20. stoljeća novi kemijski elementi nastavili su se otkrivati zahvaljujući kvantnoj mehanici i razvoju tehnike bombardiranje atoma česticama, iz druge polovice stoljeća. Pomoću ove nove tehnike bilo je moguće stvoriti umjetni elementi koji nisu prisutni u prirodi.
Iako je postignut napredak u ispravnom rasporedu elemenata u periodnom sustavu, ipak razlog ponavljajuće pojave određenih svojstava (svojstva periodični). Razvoj kvantna mehanika (grana fizike koja proučava ponašanje svjetlosti i atoma na mikroskopskoj skali) iz 1920. godine bila je presudna za objašnjenje razloga za ova svojstva.
Elektronička konfiguracija kao objašnjenje periodičnih svojstava
Tijekom prve polovice 20. stoljeća fizičari Niels Bohr Y Wolfgang Pauli predložili su atomski model u kojem elektroni mogu zauzimati samo određene orbite i gdje su elektroni raspoređeni tvoreći slojeve različitih energetskih razina. Način na koji su elektroni raspoređeni u orbitalama u različitim ljuskama ili razinama energije poznat je kao elektronička konfiguracija.
Otkriće rasporeda elektrona u elektronskim konfiguracijama bilo je temeljno za razumijevanje periodičnosti svojstava. periodično, jer je uočeno da su ta svojstva usko povezana s najudaljenijom elektroničkom konfiguracijom atoma (sloj Valencia).
Redoslijed kojim elektroni ispunjavaju atomske orbitale utvrdio je 1930. fizičar Erwin Madelung koji je uspostavio numeričko pravilo za redoslijed punjenja. Ovo je pravilo poznato kao Pravilo Madelung a to je empirijsko pravilo koje se ne bi moglo objasniti pomoću kvantne mehanike.
Slijed popunjavanja jednostavan je za prva tri retka periodnog sustava, ali u četvrti red, gdje se nalaze prijelazni elementi, redoslijed punjenja prolazi kroz niz preinake. Ukupno ima 20 anomalnih predmeta koji se ne pridržavaju ovog pravila.
Evolucija tablice nastavlja se i danas
2006. teoretski kemičar Eugen Schawrz Uspio je objasniti anomalije Madelungovog pravila uzimajući u obzir da atomi mogu imati različite elektroničke konfiguracije, ovisno o razini energije. Izračunavajući prosjeke, elektronske konfiguracije većine elemenata u skladu su s Madelungovim pravilom.
Periodni sustav i dalje je predmet rasprava u 21. stoljeću, iako je riječ o uređenju ili elektroničkoj konfiguraciji elemenata, još uvijek je valjano objasniti ovaj poredak i uočene anomalije u elektroničkim konfiguracijama pomoću a teorija.
Ako želite pročitati više članaka sličnih Evolucija periodnog sustava - sažetak, preporučujemo da uđete u našu kategoriju Atom.
Bibliografija
Razni autori. (2019)Posebno: periodni sustav. Istraživanje i znanost. Barcelona: Scientific Press S.A.
