Struktura i karakteristike atoma

Slika: SlidePlayer
Atomi su dio našeg svijeta. Sva je materija sačinjena od atoma, stoga je važno bolje razumjeti od čega se sastoje i koje su njihove funkcije. U ovoj lekciji od UČITELJA reći ćemo vam što struktura atoma i karakteristike. Ako želite znati više o česticama koje čine svu materiju, nastavite čitati ovaj članak.
Indeks
- Što su atomi?
- Građa atoma
- Glavne karakteristike atoma
- Što su izotopi?
- Kako se atomi nalaze u prirodi?
Što su atomi?
The atom to je najmanja jedinica na koju se materija može podijeliti a da pritom ne izgubi svoja kemijska svojstva, odnosno svojstva kao kemijski element. Atom je ishodište svega što se može vidjeti ili dodirnuti, od zvijezda do vašeg jutrošnjeg doručka.
Ako ostavimo po strani gubitak njegovih kemijskih svojstava, možemo reći da se atom sastoji od različitih čestica, nazvanih subatomske čestice. Postoje tri vrste subatomskih čestica -protoni, neutroni i elektroni- s različitim karakteristikama.
Te se čestice grupiraju u različite brojeve kako bi tvorile kemijske elemente (kisik, ugljik itd.), Ali će se uvijek raspodijeliti slijedeći fiksnu strukturu.

Slika: Google Sites
Građa atoma.
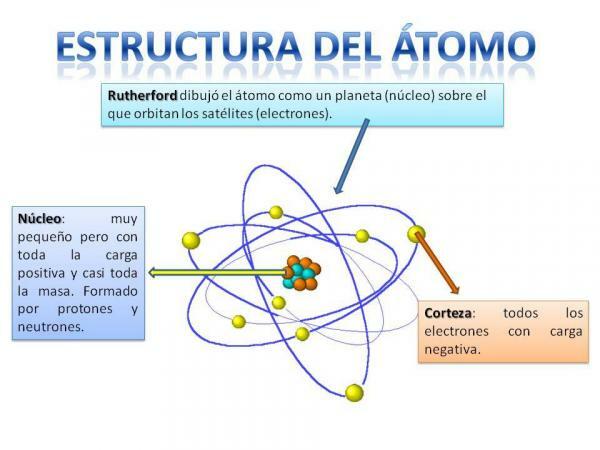
Struktura atoma je fiksna, to jest, možemo imati različite vrste atoma (atom vodika, atom kisika, itd.), ali njihove su subatomske čestice uvijek organizirane na sličan način kao planetarni sustav.
Sigurno ćete se sjetiti kako je organiziran Sunčev sustav: Sunce je u središtu i oko njega od toga se planeti okreću opisujući različite orbite, neke bliže, a druge udaljenije od Sunce. U slučaju atoma, u središtu je jezgra, oblika sličnog kupini i sastoji se od neutronima i protoni.
Oko jezgre je Korteks što je područje kroz koje elektroni. Prije se smatralo da elektroni opisuju određene orbite, slično onome kako to čine planeti, iako je to sada slučaj zna da te putanje nisu tako dobro definirane i da su više poput područja u kojima ćemo se vjerojatnije naći elektroni.
Slika: REA - planiraj Ceibal
Glavne karakteristike atoma.
Da biste nastavili s ovom lekcijom o strukturi atoma i karakteristikama, važno je usredotočiti se na elemente zbog kojih se atom smatra takvim.
A za ovo moramo odgovoriti na ovo pitanje: Zašto se svi atomi odlučuju poredati na taj određeni način? Odgovor je jednostavan: to je zbog električne privlačne sile. Jezgru atoma čine neutroni koji nemaju električni naboj i protoni koji imaju pozitivan električni naboj. a elektroni imaju negativan električni naboj, pa postoji slična privlačna sila između jezgre i elektrona proizveden između dva pola magneta, ali nije dovoljno jak da elektroni "padnu" na jezgra.
To se bolje razumije ako uzmemo u obzir veličina jezgre: da atom ima, na primjer, dimenziju nogometnog stadiona, jezgra bi imala dimenziju lopte u središtu s terena Koliku bi privlačnu silu morala napraviti nogometna lopta da tribine stadiona padnu na nju!
Funkcija neutrona
Sad se možda pitate i koju ulogu igraju neutroni? Iako nemaju električni naboj, neutroni imaju veliku ulogu u atomu: oni doprinose 99% mase. Ako vam pomaže da se sjetite, možemo reći da je atom poput bande trojice prijatelja: teški neutron, pozitivni proton i negativni elektron koji se vrti oko kruga oko neutrona i elektron.
Kretanje elektrona
U ovom trenutku želim da se vratimo nečemu što nam je ostalo u tintarnici: putanjama koje elektroni opisuju oko jezgre. To smo već rekli elektroni se okreću oko jezgre kao što to čine planeti oko Sunca, neki bliži od drugih, zašto to čine? Elektroni se okreću u jednoj ili drugoj ljusci u skladu s energijom koju moraju odmaknuti od jezgre, tj. Oni elektroni koji su bliže jezgri nemaju dovoljnu silu da se odmakne od jezgre, dok oni u najudaljenijim slojevima (orbitalama) kore imaju više energije i mogli su se dalje odmaknuti od jezgre. jezgra. Nadalje, u svakoj od orbitala postoji maksimalni kapacitet od 8 elektrona (pravilo okteta).
Čestice atoma
Vratit ćemo se drugom pristupu koji smo radili ranije, ali nismo objasnili: atomi su sačinjeni neutroni, protoni i elektroni, koji se uvijek kombiniraju slijedeći istu strukturu jezgre i kore, ali to čine u različitom broju kako bi stvorili različite kemijske elemente. Kako možemo dobiti toliko elemenata koji kombiniraju samo 3 vrste čestica? Kemijski elementi, koje ste ikada vidjeli predstavljene u periodnom sustavu, karakterizirani su određenim atomskim brojem.
The atomski broj (Z) Kaže nam broj protona u jezgri ove vrste atoma, koji je jednak broju elektrona u normalnim uvjetima. Tako će, na primjer, svi atomi koji imaju 6 protona (Z = 6) biti atomi ugljika i imat će ista kemijska svojstva; atomi s 5 protona (Z = 5) bit će atomi bora, jednakih međusobnih kemijskih svojstava i različitih od atoma ugljika. Ne morate brkati atomski broj s atomskom težinom ili maseni broj (A), što je zbroj težine neutrona i protona (težina elektrona je zanemariva s obzirom na težinu ukupne jezgre).

Slika: SlidePlayer
Što su izotopi?
U prirodi možemo pronaći različite "podvrste" elemenata, izotopi. Siguran sam da ste u nekom trenutku čuli za ugljik 14, radioaktivni izotop ugljika koji se koristi, između ostalog, za starost fosila. Izotopi su dva atoma s jednakim brojem protona (isti atomski broj), ali različit broj neutrona, (različita atomska masa). Izotopi istog elementa obično se imenuju imenom elementa nakon kojeg slijedi njegova atomska masa.
U našem primjeru, oba su izotopa ugljik, pa imaju atomski broj 6 (Z = 6), ali ugljik 12 ("normalni" ugljik) ima atomsku težinu 12 naspram atomske težine ugljika 14 14. Izotopi istog elementa imaju vrlo slična kemijska i fizikalna svojstva. U slučaju ugljika 14, za razliku od ugljika 12, radi se o radioaktivnom izotopu koji je prisutan u svim elementima koji sadrže ugljik, uključujući i živa bića.
I ovim završavamo ovu lekciju o strukturi atoma i karakteristikama. Nadamo se da vam je bio od pomoći.

Slika: Vaši zadaci
Kako se atomi nalaze u prirodi?
Atomi se mogu naći izolirano, ali najnormalnije je pronaći ih kombinirane u skupinama pozvao molekule.
Molekule se mogu sastojati od atoma istog elementa (kao što je molekula kisika, sastavljena od dva atoma kisika) ili skupinama s atomima različitih elemenata (dva atoma vodika i jedan kisik tvore molekulu Voda). Te se skupine elemenata nazivaju molekulama, koje se pak mogu međusobno kombinirati i tvoreći različite sve složenije skupine prema reaktivnosti i kemijskom afinitetu za izvor kemijske veze.
Ako želite pročitati više članaka sličnih Struktura i karakteristike atoma, preporučujemo da uđete u našu kategoriju Atom.
