10 vrsta kemijskih veza (objašnjeno na primjerima)
Kemijske veze su sile koje atome drže zajedno da tvore molekule. Postoje tri vrste veza između atoma:
- Metalna veza.
- Jonska veza.
- Kovalentna veza: nepolarna, polarna, jednostavna, dvostruka, trostruka, dativna.
Zahvaljujući tim vezama nastaju svi spojevi koji postoje u prirodi. Postoje i sile koje molekule drže zajedno, poznate kao intermolekularne veze, kao što su:
- Vodikove veze ili mostovi.
- Dipol-dipolne sile.
Zatim ćemo objasniti svaku od ovih poveznica.
| Vrste kemijskih veza | Karakteristična | Primjeri | |
|---|---|---|---|
| Metal | Ioni metala plutaju u moru elektrona u pokretu. | Metalni elementi: natrij, barij, srebro, željezo, bakar. | |
| Jonski | Prijenos elektrona s jednog atoma na drugi. | Na natrijev klorid+Kl- | |
| Kovalentni | Nepolarna | Podijelite elektrone jednako između dva atoma. | Molekularni vodik H-H ili H2 |
| Polarni | Neravnomjerno dijeli elektrone između dva atoma. | Molekula vode H2ILI | |
| Jednostavan | Podijelite par elektrona. | Molekula klora Cl2 Cl-Cl | |
| Dvostruko | Podijelite dva para elektrona. | Molekula kisika O2 O = O | |
| Utrostručiti | Podijelite tri para elektrona. | Molekula dušika N≣N ili N2 | |
| Dativ | Samo jedan od atoma dijeli elektrone. | Veza između dušika i bora u spoju amonijak-bor trifluorid. | |
| Intermolekularne sile | Vodikov most | Vodike u jednoj molekuli privlače elektronegativni atomi druge molekule. | Vodikove veze između vodika u jednoj molekuli vode i kisika u drugoj molekuli vode. |
| Dipol-dipol | Molekule s dva električna pola privlače suprotne polove ostalih molekula. | Interakcije između molekula metana H2C = O |
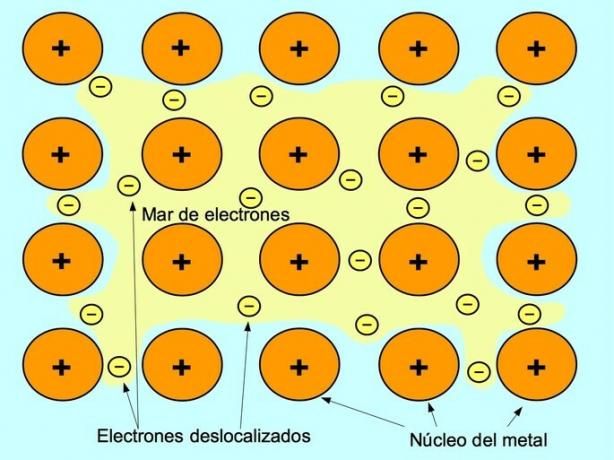
Metalna veza
Metalna veza je sila privlačenja između pozitivnih iona metalnih elemenata i negativnih elektrona koji se slobodno kreću između iona. Atomi metala su čvrsto zbijeni, što omogućuje elektronima kretanje unutar rešetke atoma.
U metalima se valentni elektroni oslobađaju od svog izvornog atoma i tvore "more" elektrona koje pluta oko cijele metalne strukture. To uzrokuje da se atomi metala transformiraju u pozitivno nabijene metalne ione koji se spakiraju.
Metalna veza uspostavlja se između metalnih elemenata kao što su natrij Na, barij Ba, kalcij Ca, magnezij Mg, zlato Au, srebro Ag i aluminij Al.
Jonska veza
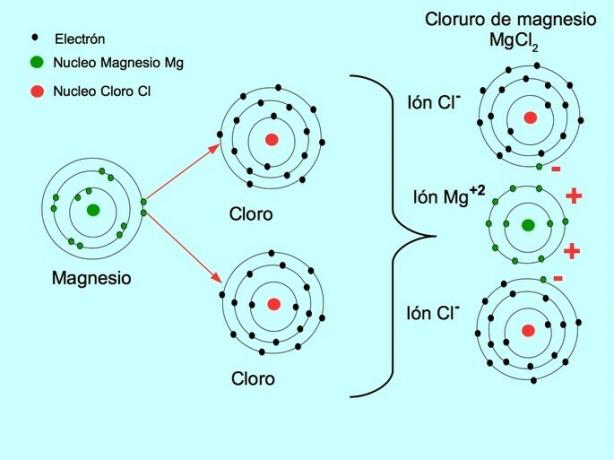
Jonska veza je sila koja spaja metalni element, poput natrija ili magnezija, s nemetalnim elementom, poput klora ili sumpora. Metal gubi elektrone i pretvara se u pozitivni metalni ion tzv kation. Ti elektroni prelaze u nemetalni element i on se pretvara u negativno nabijeni ion koji se naziva anion.
Kationi i anioni kombiniraju se i tvore trodimenzionalnu mrežu koja se održava snagama elektrostatičke privlačnosti između iona s različitim nabojima. Te sile tvore ionske spojeve.
Zemljinu koru uglavnom čine ionski spojevi. Većina stijena, minerala i dragog kamenja su jonski spojevi. Na primjer:
- Natrijev klorid NaCl: metalni element je natrij koji prenosi elektron u klor, koji je nemetalni element.
- Magnezijev klorid MgCl2: Magnezij Mg donira dva elektrona na dva atoma klora, kao što je prikazano na donjoj slici:
Vidi također Razlika između kationa i aniona.
Kovalentna veza
Kovalentna veza nastaje kada dva nemetalna atoma dijele elektrone. Ova veza može biti nekoliko vrsta, ovisno o afinitetu za elektrone atoma i količini zajedničkih elektrona.
Nepolarna kovalentna veza
Nepolarna kovalentna veza je veza koja nastaje između dva atoma gdje su elektroni podijeljeni podjednako. Ta se veza normalno javlja u simetričnim molekulama, odnosno molekulama sačinjenim od dva jednaka atoma, poput molekule vodika H2 i molekula kisika O2.

Polarna kovalentna veza
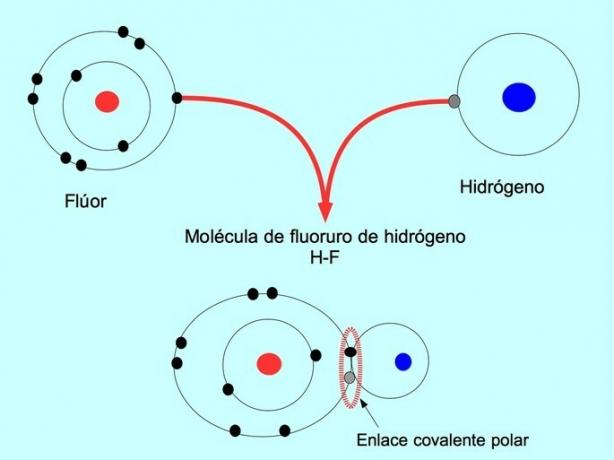
Polarna kovalentna veza nastaje kada dva atoma dijele elektrone, ali jedan od njih ima veću privlačnost za elektrone. Zbog toga molekula ima negativniji "pol" s više elektrona, a suprotni pol je pozitivniji.
Molekule s ovom raspodjelom ili neravnotežom elektrona poznate su kao polarne. Na primjer, u vodikovom fluoridu HF postoji kovalentna veza između vodika i fluora, ali fluor ima veću elektronegativnost, pa snažnije privlači elektrone podijeljeni.
Jednostavna kovalentna veza
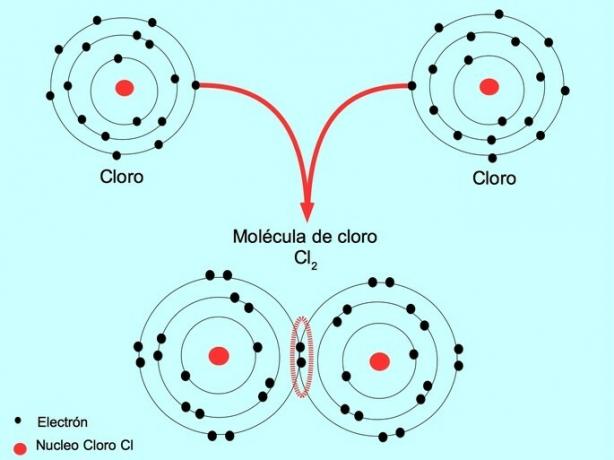
Kada dva atoma dijele dva elektrona, po jedan iz svakog, nastala kovalentna veza naziva se jednostavnom kovalentnom vezom.
Na primjer, klor je atom koji u svojoj vanjskoj ovojnici ima sedam valentnih elektrona, koji se mogu napuniti s osam elektrona. Klor se može kombinirati s drugim klorom da tvori molekulu klora Cl2 koji je mnogo stabilniji od samog klora.
Dvostruka kovalentna veza
Dvostruka kovalentna veza je veza u kojoj se između dva atoma dijele četiri elektrona (dva para) elektrona. Primjerice, kisik u posljednjoj ljusci ima 6 elektrona. Kada se kombiniraju dva kisika, četiri se elektrona dijele, što uzrokuje da svaki ima 8 elektrona u posljednjoj ljusci.
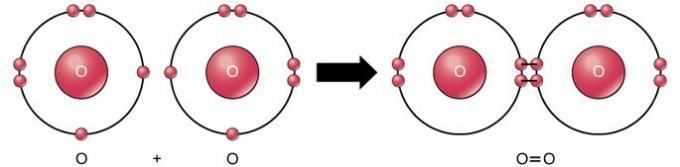
Trostruka kovalentna veza
Trostruka kovalentna veza nastaje kada se između dva atoma podijeli 6 elektrona (ili tri para). Na primjer, u molekuli hidrogen-cijanida HCN stvara se trostruka veza između ugljika i dušika, kako je prikazano na donjoj slici:
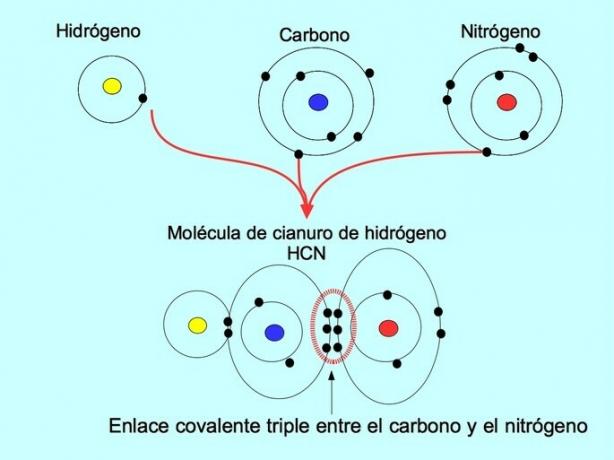
Koordinatna ili dativna kovalentna veza
Koordinirana ili dativna kovalentna veza je veza koja nastaje kada samo jedan od atoma veze doprinosi paru elektrona. Na primjer, kada amonijak NH reagira3 s bor trifluoridom BF3, Dušik se s dva elektrona veže izravno za bor koji nema raspoloživih elektrona za dijeljenje. Na taj način i dušiku i boru ostaje 8 elektrona u valentnoj ljusci.
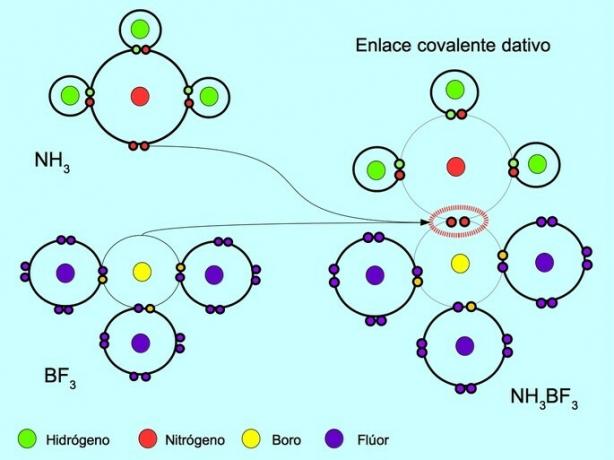
Vidi također Organski i anorganski spojevi.
Intermolekularne veze
Molekule se udružuju pomoću sila koje omogućuju stvaranje tvari u tekućem ili krutom stanju.
Dipol-dipolne veze ili sile
Slabe intermolekularne veze mogu se uspostaviti između polarnih molekula kada negativni polovi privlače pozitivne polove i obrnuto. Na primjer, metanal H2C = O je polarna molekula, s djelomičnim negativnim nabojem na kisiku i djelomičnim pozitivnim nabojem na vodikovima. Pozitivna strana jedne molekule metana privlači negativnu stranu druge molekule metana.
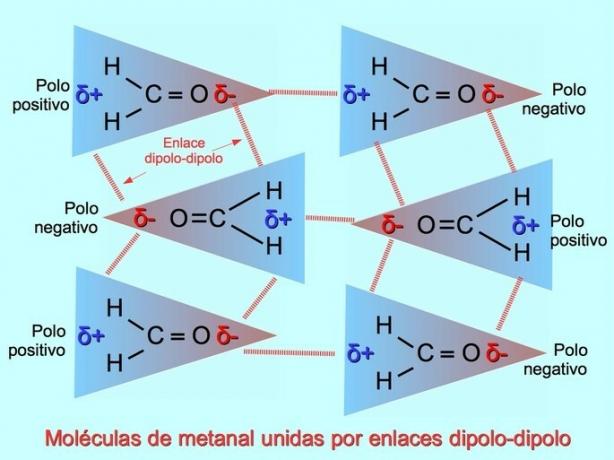
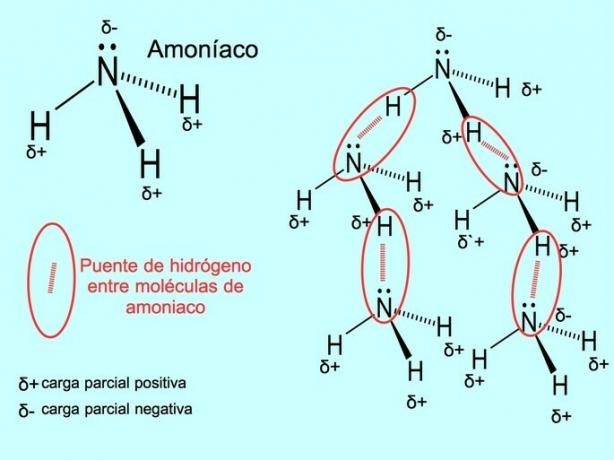
Vodikove veze ili veze
Vodikova veza ili vodikova veza veza je koja se uspostavlja između molekula. Pojavljuje se kada je vodik u molekuli kovalentno vezan za kisik, dušik ili fluor. Kisik, dušik i fluor atomi su s većom elektronegativnošću, pa jače privlače elektrone kada ih dijele s drugim manje elektronegativnim atomom.
Između molekula vode H postoje vodikove veze2O i amonijak NH3 kao što slika prikazuje:
Možda će vas zanimati sljedeće:
- Atomi i molekule.
- Primjeri organskih i anorganskih spojeva.
- Metali i nemetali
Reference
Zumdahl, S.S., Zumdahl, S.A. (2014) Kemija. Deveto izdanje. Brooks / Cole. Belmont.
Commons, C., Commons, P. (2016) Heinemannova kemija 1. 5. izdanje. Pearson Australija. Melbourne.


