Razlika između jakih i slabih kiselina i baza (s primjerima)
Klasifikacija kiselina i baza u kemiji ovisi o ionizacijskoj sili tih tvari u vodenom mediju. A) Da:
- a kiselina i baza su jaki kad su potpuno ionizirani, odnosno u procesu ionizacije potpuno se transformiraju u katione ili pozitivne ione i u anione ili negativne ione.
- S druge strane, kiselina i baza su slabe kada su djelomično ionizirani u vodi, odnosno u otopini, bit će udio kationa, drugi udio aniona i drugi udio nedisociranih molekula.
| Jake kiseline i baze | Slabe kiseline i baze | |
|---|---|---|
| Definicija | Tvari koje se u otopini potpuno ioniziraju. | Tvari koje se djelomično ioniziraju u otopini. |
| Jonizacija | Kompletna | Djelomično |
| Elementi u vodenoj otopini | Kationi i anioni u istoj koncentraciji. | Kationi, anioni i molekule u različitim omjerima. |
| Konstanta jonizacije | Povišen | Malo |
| Primjeri |
|
|
Jake kiseline i baze
A kiselina ili baza su jaki kada se u vodenom mediju potpuno disocirajuDrugim riječima, postupak ionizacije je dovršen i otopina će sadržavati istu koncentraciju aniona i kationa.
Kako jonizirate kiselinu i jaku bazu?
Jaka kiselina, poput klorovodične kiseline HCl, ionizira se na sljedeće načine:
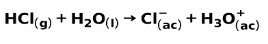
Jaka baza, poput natrijevog hidroksida NaOH, ionizira se na sljedeće načine:
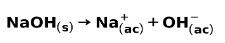
Primjeri jakih kiselina i njihove formule
| Jake kiseline | Formula |
|---|---|
| Klorovodična kiselina | HCl |
| Sumporne kiseline | H2SW4 |
| Dušična kiselina | HNO3 |
| Bromovodična kiselina | HBr |
| Perklorna kiselina | HClO4 |
| Kromna kiselina | H2CrO4 |
| Tetrafluorborna kiselina | HBF4 |
Primjeri jakih baza i njihove formule
| Jaka baza | Formula |
|---|---|
| Natrijev hidroksid | NaOH |
| Litijev hidroksid | LiOH |
| Kalij hidroksid | KOH |
| Rubidijev hidroksid | RbOH |
| Cezijev hidroksid | CsOH |
| Kalcijev hidroksid | Ca (OH)2 |
| Barijev hidroksid | Ba (OH)2 |
| Stroncijev hidroksid | Sr (OH)2 |
| Aluminijev hidroksid | Al (OH)3 |
Možda će vas zanimati više primjeri kiselina i baza.
Slabe kiseline i baze
A Kiselina ili baza su slabe kad se djelomično ioniziraju u vodenoj otopini, odnosno u otopini se nalaze ioni i nejonizirane molekule.
Kako jonizirate kiselinu i slabu bazu?
Slaba kiselina, poput octene kiseline CH3COOH, ionizira se na sljedeći način:
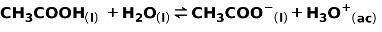
Ravnoteža ove reakcije izražava se dvjema strelicama u suprotnim smjerovima.
Kad se slaba kiselina disocira ili ionizira, uspostavlja se ravnoteža između vrsta prisutnih u otopini; to se može izraziti a konstanta ionizacijekiselo:
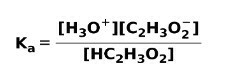
Konstanta ionizacije nije ništa drugo doli omjer umnožavanja koncentracije proizvoda nad umnožavanjem koncentracije reaktanata.
Slaba baza, poput NH amonijaka3, ionizira se na sljedeći način:
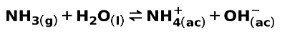
Kad se slaba baza disocira ili ionizira, uspostavlja se ravnoteža između vrsta prisutnih u otopini; to se može izraziti a osnovna konstanta ionizacije:
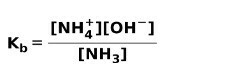
Možda će vas zanimati razlika između Kiseline i baze.
Primjeri slabih kiselina s njihovom formulom i konstantom ionizirajuće kiseline Kdo
| Slaba kiselina | Formula | Konstanta jonizacije |
|---|---|---|
| Mravlja kiselina | H2CO2 | 1,77 x 10-4 |
| Octena kiselina | H3CCOH | 1,75 x 10-5 |
| Cijanovodična kiselina | HOCN | 3,30 x 10-4 |
| Vodikov cijanid | HCN | 6,20 x 10-10 |
| Klorovodična kiselina | HOCl | 3,50 x 10-8 |
| Dušična kiselina | HNO2 | 4,00 x 10-4 |
| Mliječna kiselina | HC3H5ILI3 | 1,40 x 10-4 |
| Karbonska kiselina | H2CO3 |
4,30 x 10-7 5,60 x 10-11 |
| Borna kiselina | H3BO3 |
5,80 x 10-10 1,80 x 10-13 3,00 x 10-14 |
Primjeri slabih baza s njihovom formulom i osnovnom ionizacijskom konstantom Kb
| Slaba baza | Formula | Konstanta jonizacije |
|---|---|---|
| Amonijak | NH3 | 1,75 x 10-5 |
| Metilamin | CH3NH2 | 4,38 x 10-4 |
| Etilamin | C2H5NH2 | 5,60 x 10-4 |
| Anilin | C6H5NH2 | 3,80 x 10-10 |
| Piridin | C5H5N | 1,70 x 10-9 |
| Benzilamin | C7H9N | 2,20 x 10-5 |
| Natrijev bikarbonat | NaHCO | 2,00 x 10-4 |
Možda će vas zanimati više o tome Karakteristike kiselina i baza