Karakteristike kiselina i baza: glavne razlike
Karakteristike kiselina i baza su sva ona svojstva i kvalitete s kojima možemo razlikovati kiselinu od baze.
Prema Arrehniusovoj teoriji, a kiselina je tvar koja oslobađa protone H+ kada se otopi u vodi i baza je bilo koja tvar koja oslobađa hidroksilne ione OH- kada je u vodenoj otopini.
| Kiseline | Baze | |
|---|---|---|
| Stvaranje jona | Predstaviti | Predstaviti |
| Reakcija neutralizacije | Kad reagira s bazom. | Kad reagira s kiselinom. |
| Topljivost u vodi | Topljiv | Djelomično topljiv. Hidroksidi kalcija, barija i aluminija slabo su topljivi. |
| Električna vodljivost | Predstaviti | Predstaviti |
| Stanje materije | Čvrsta, tekuća ili plinovita | Čvrsta, tekuća ili plinovita |
| Reakcija s lakmus papirom | Crvena boja | Plava boja |
| Vrijednost PH | Ispod 7 | Veći od 7 |
| Konjugirani pandan | Slaba kiselina tvori konjugiranu bazu. | Slaba baza tvori konjugiranu kiselinu. |
| Korozivno djelovanje | Jake kiseline | Jake baze |
Karakteristike kiselina
Kiseline imaju nekoliko karakteristika s kojima ih se može identificirati.
Sposobnost stvaranja iona iz kiselina
Glavna karakteristika kiselih tvari je da se mogu ionizirati, odnosno izgubiti ili dobiti elektrone.
Klorovodična kiselina HCl, jaka kiselina, ionizira se stvarajući kloridni anion Cl- i protona H+.
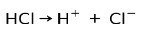
Reakcija neutralizacije
Kiselina reagira s bazom stvarajući sol i vodu. Ova reakcija je poznata kao reakcija neutralizacije. Na primjer, HCl reagira s NaOH stvarajući natrijev klorid NaCl (kuhinjska sol) i vodu:
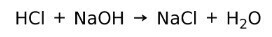
Topivost kiselina u vodi
Kiseline su općenito topljive u vodi. Na primjer, klorovodična kiselina ili muriatska kiselina umjereno su topive u vodi, do 82 g HCl može se otopiti u 100 ml vode na 0 ° C. U slučaju sumporne kiseline H2SW4, smjesa s vodom stvara toplinu, pa je uvijek preporučljivo dodati kiselinu u vodu kako bi se izbjegle eksplozije.
Jačina kiseline
Način razdvajanja kiselina određuje jesu li jake ili slabe. Snaga kiseline daje se njenom konstanta disocijacije.
Dušična kiselina HNO3 to je jaka kiselina jer se u vodenoj otopini potpuno ionizira u protone i nitratne ione:

To znači da kada dodamo HNO3 u vodi, pri analizi vode naći ćemo samo H+ i nitratnih iona, i gotovo bez HNO3.
Umjesto toga, octena kiselina koja se nalazi u octu je slaba kiselina, jer je samo njegov dio razdvojen:
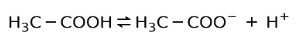
Zbog toga je prikazan strelicama u dva smjera, to znači da ćemo u vodenoj otopini imati octenu kiselinu, H+ i acetat anion (H3C-COO-).
Stanja tvari kiselina
Kiseline se mogu naći u tekućem, krutom ili plinovitom stanju. Na primjer, klorovodična kiselina HCl je tekućina, sumporovodik HS je plin, a oksalna kiselina je krutina.
Reakcija s lakmusovim papirom od kiselina

Kad traku lakmus papira stavimo u kiselu tvar, lakmus papir postaje crven.
Identifikacija kiselina prema njihovom pH
PH je mjera količine H+ prisutna u otopini. Tako smo između pH 0 i 7 u prisutnosti kiseline. Na primjer, ocat ima pH jednak 2, pH sumporne kiseline u automobilskim akumulatorima jednak je 1.
Električna vodljivost kiselina
Budući da kiseline mogu disocirati i proizvesti električki nabijene ione, kisele otopine mogu provoditi električnu energiju. Na primjer, unutar akumulatora, sumporna kiselina, koja je jaka kiselina, koristi se kao vodič električne energije.
Korozivno djelovanje jakih kiselina
Jake kiseline djeluju korozivno, mogu sagorjeti organska tkiva pa rukovanje njima mora biti izuzetno oprezno.
Slabe kiseline čine konjugirani pandan
Kad se otope, slabe kiseline tvore ono što je poznato kao konjugirani par, odnosno slaba kiselina tvori konjugiranu bazu.
Na primjer:

U ovom slučaju, mravlja ili metanska kiselina (HCOOH), kad se disocira, tvori konjugirani bazni ionski format.
To bi vas moglo zanimati:
- Jake i slabe kiseline i baze.
- Primjeri kiselina i baza.
Karakteristike baza
Dalje predstavljamo svojstva baza ili alkalnih otopina koje ih karakteriziraju.
Kapacitet jonizacije baze
Osnovne ili alkalne tvari karakteriziraju stvaranje iona kada se otope u vodi:

U ovom slučaju, natrijev hidroksid NaOH ionizira stvarajući hidroksidni anion OH- i natrijev kation Na+.
Baza reagira s kiselinom stvarajući sol
Baza reagira s kiselinom u reakciji neutralizacije dajući vodu i sol, na primjer:

U ovom slučaju, aluminij hidroksid Al (OH)3baza, reagira s HCl i stvara sol aluminij-klorida AlCl3 i vode. Aluminijev hidroksid koristi se kao antacid za ublažavanje želučanog refluksa neutraliziranjem kiseline koju stvara želudac.
Temelje se na topljivosti u vodi
Neke baze su topive u vodi. Zemnoalkalijski hidroksidi, poput kalcijevog hidroksida i barijevog hidroksida, slabo su topljivi u vodi. Na primjer, natrijev hidroksid ili kaustična soda mogu se otopiti 109 g u 100 ml vode na 20 ° C. Dok magnezijev hidroksid ili magnezijevo mlijeko Mg (OH)2 praktički je netopiv u vodi.
Osnovna čvrstoća
Ovisno o stupnju ionizacije baze, one mogu biti jake ili slabe. Na primjer, litijev hidroksid je a jaka baza jer se u vodenoj otopini potpuno ionizira u hidroksidne ione OH i litijeve katione Li+:
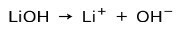
S druge strane, amonijak NH3 je slaba baza jer kad dođe u kontakt s vodom, ne disocira sav amonijak:
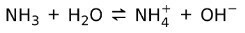
Stanje tvari u bazama
Baze se mogu naći u krutom, tekućem i plinovitom stanju. Na primjer, čisti natrijev hidroksid je čvrst, amonijak je plin.
Reakcija s lakmusovim papirom baza
Kad u alkalnu tvar stavimo traku lakmus-papira, papir postaje plav.
Identifikacija baza prema njihovom pH
Baze su karakterizirane time što imaju pH između 7 i 14.
 Električna vodljivost baza
Električna vodljivost baza
Baze su zbog svog ionizacijskog kapaciteta dobri vodiči električne energije. Na primjer, u alkalnim baterijama kalijev hidroksid KOH koristi se kao električni vodič.
Korozivno djelovanje baza
Jake baze mogu oštetiti organska tkiva. Primjerice, sredstva za čišćenje kuhinjskih pećnica uglavnom su jaka osnova i uvijek se preporučuje rukovati s njima vrlo oprezno, noseći rukavice i zaštitu za oči.
Slabe baze tvore konjugirani pandan
Slabe baze kada se otope tvore konjugirani parnjak, odnosno slaba baza tvori konjugiranu kiselinu.
Na primjer, tris- (hidroksimetil) amino metan (OHCH2)3CNH2 je slaba baza čija je konjugirana kiselina (OHCH2)3CNH3+:
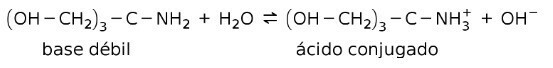
To je osnova djelovanja tampon tvari odn pufer, koji su tvari koje se koriste za stalno održavanje pH otopina.
Možda će vas zanimati razlike između:
- Kiseline i baze.
- Kationi i anioni



