Što su KEMIJSKE FORMULE i čemu služe [SAŽETAK + VIDEOZAPIS]
Iako se ne čini, kemijski elementi periodnog sustava Oni nas okružuju sa svih strana. Međutim, mnogo puta se ne nalaze zasebno, već tvore molekule ili makromolekule različitih kemijskih elemenata. Kemijske formule su grafički izraz ovih spojeva i koriste se kako bi se standardizirala njihova nomenklatura. U ovoj lekciji od UČITELJA ćemo vidjeti što su kemijske formule i čemu služe. Pridružite nam se da saznate više!
The kemijske formule su grafički izraz elemenata koji čine kemijski spojevi.
Ove kemijske formule nisu proizvoljne, ali slijede neke stroga pravila kemijske nomenklature, koju je utvrdio IUPAC (Međunarodna unija čiste i primijenjene kemije).
Kemijske formule također nam pružaju informacije o elementi koji čine molekulu, tako nam, na primjer, govori broj i odgovarajuće proporcije svakog od atoma koji ga čine, a ponekad čak i vrstu Kemijska veza koji postoji između tih elemenata.
Svaka molekula ili makromolekula koja postoji odgovara svojoj kemijskoj formuli, koliko god ih ima različite vrste formula
. Svaka od ovih vrsta daje nam različite informacije o molekuli, ali sve nam pomažu da je razumijemo kemijske prirode i pomaže nam razumjeti što se događa u kemijskim reakcijama i kako se jedan spoj može transformirati u drugi.Ali da bi se razumjela ova kemijska nomenklatura, potrebno je imati određeno znanje iz kemije, jer se oni pokoravaju prilično specijaliziranom tehničkom jeziku.

Slika: Slideplayer
The kemijske formule predstavljaju unija kemijskih simbola, s odgovarajućim slovom svakog atoma kako dolazi u periodni sustav elemenata, i indeksi, koji su brojevi koji predstavljaju njihov iznos atoma u molekuli
Unutar kemije (i organske i anorganske) postoje određeni fragmenti ili spojevi koji pokazuju određeno ponavljanje i strukturno i funkcionalno i identificirani su imenima specifično. Kada ovi fragmenti imaju slobodne elektrone koji se ne dijele, nazivaju se radikali i oni su nestabilni, vrlo reaktivni spojevi s kratkim poluživotom.
Primjeri radikala su metilne skupine CH3, nitratne skupine NO3, hidroksilne skupine OH- ili radikal Cl-. Međutim, one su poznate kao funkcionalne skupine kada su atomi ili skupine atoma spojene na lanac ugljični dioksid (s raznim ugljikom) i koji su odgovorni za reaktivnost i kemijska svojstva molekule.
Ove su skupine posebno važne u organskoj kemiji (ljudske biomolekule su u osnovi ugljik i vodik). Neki primjeri funkcionalnih skupina su karbonilna skupina = C = O ili karboksilnu skupinu -COOH.

Slika: Monogramas.com
kao što smo rekli, postoji nekoliko vrsta kemijskih formula. Svaka od ovih formula daje nam različitu vrstu informacija o molekulama i, stoga, služi određenom cilju, a da ijedna formula nije bolja ili gora od druge općenito.
Klase kemijskih formula koje razlikujemo su:
Empirijske formule
Empirijske formule su najjednostavnije formule za predstavljanje kemijske molekule, ponekad govoreći da su minimalne formule. Ove formule predstavljaju udio atoma svakog od elemenata u molekuli, koji su pojednostavljeni na cijele brojeve, uvijek najmanji. Primjer ove formule je CH3 (metilna skupina), s tri atoma vodika i jednim atomom ugljika.
Međutim, ove formule ponekad mogu dati pogrešne predodžbe o sastavu molekule. To se događa kada formula ne označava stvarni broj atoma u molekuli, kao kod peroksida vodik, čija je empirijska formula HO kada formula treba biti H2O2 (dva atoma vodika i dva atoma kisik). To se tako događa kroz konvenciju o nomenklaturi, budući da su oba indeksa jednaka, oni su pojednostavljeni.
Neki se spojevi, međutim, mogu predstaviti samo empirijskim formulama, budući da se sastoje od ionskih mreža. To se događa na primjer u običnoj soli ili natrijevom kloridu, koji je predstavljen kao NaCl, što ukazuje da za svaki natrij postoji klor.
Molekularne formule
Ove vrste formula su prilično osnovne, one jednostavno izražavaju vrstu atoma i broj svakog od njih prisutnih u kovalentnoj molekuli. To su formule koje prikazuju kemijske elemente i broj na linearan način (u obliku indeksa. Primjer ove vrste formule je kada se glukoza zove C6H12O6, što izražava glukozu Molekula glukoze sastoji se od šest atoma ugljika, dvanaest atoma vodika i šest kisik.
Molekularne formule se naširoko koriste, a ponekad se kaže da su to prave formule molekula. U mnogim slučajevima, one se podudaraju s empirijskim formulama, na primjer u CO2.
Polurazvijene formule
Polurazvijene formule su vrsta formula koja je slična molekularnim formulama, jer izražavaju i atome koji čine molekulu i njihov broj, ali i pružiti informacije o kemijskim vezama (predstavljenim linijama između atoma) i vrsti veze između atoma ugljika koji je tvore (ako su jednostavne, dvostruke ili trostruke). Polurazvijena formula korisna je za identifikaciju radikala koji čine molekulu i njezinu kemijsku strukturu (veze između atoma ugljika i vodika nisu zastupljene).
U slučaju glukoze, njena polurazvijena formula je CH2OH - CHOH - CHOH - CHOH -CHOH - CHO i kao što se može vidjeti atomi ugljika, vodika i kisik su isti kao u molekularnoj formuli (šest, dvanaest i šest, redom) i sve jednostruke veze (glukoza ima samo veze jednostavan). Ova formula je stoga složenija formula od molekularne formule.
Polurazvijene formule ponekad se nazivaju kondenziranim i možda su najraširenija klasa formula. koriste, osobito u organskoj kemiji, iako nam ne dopuštaju promatranje stvarne geometrije molekula.
Razvijena formula
Razvijene formule su nešto složenije od polurazvijenih. U ovoj vrsti formula, veza i položaj svakog atoma u molekuli prikazani su u kartezijskoj ravnini, sve dok se ne prikaže cijeli spoj.
Strukturna formula
Strukturna formula je grafički prikaz strukture molekule u prostoru, dajući nam informacije o redu i raspodjeli atoma u prostoru. U ovoj formuli su također prikazane kemijske veze koje čine molekulu i jesu li jednostruke, dvostruke ili trostruke. Ova formula je, dakle, ona koja nam daje najviše informacija o molekuli.
Ove vrste formula se više koriste na profesionalnoj razini u svijetu kemije, jer omogućuju mnogo jasnije sagledavanje kemijskih reakcija ili sinteze novih molekula.
Lewisove formule
To su složene, vrlo specifične i tehničke formule. Oni su također poznati kao Lewisovi dijagrami ili strukture i slični su razvijenim formulama molekula, ali Osim toga, naznačeni su elektroni koje atomi dijele u svakoj kemijskoj vezi, koji variraju s valencijom atoma uključeni.
U ovim formulama veze između atoma su predstavljene linijama (koji također pokazuju jesu li jednostruke, dvostruke ili trostruke) ili s parom točaka. Usamljeni elektroni ili elektroni koji nisu zajednički u vezi, predstavljeni su točkama oko atoma kojemu ona odgovara.

Slika: Organska kemija
Prilikom pisanja formula ponekad se upućuje naoksidacijski broj elementa (često je u ionskim spojevima). To su skup pozitivnih i negativnih brojeva koji idu povezana sa svakim elementom.
- Oksidacijski brojevi mogu se tumačiti kao broj elektrona da element dijeli kovalentnu vezu ili se prenosi u ionsku vezu.
- Kada je znak oksidacije iznad atoma negativan, znači da ovaj element hvata elektrone i broj koji ga prati pored je broj zarobljenih elektrona. Stoga, oksidacijsko stanje od -1 znači da element pokupi jedan elektron, -2 da pokupi dva, i tako dalje.
- Kada je znak oksidacije pozitivan, atom odustaje od elektrona, a broj koji prati ovaj znak je broj predanih elektrona. Slično, oksidacijsko stanje +1 znači da daje jedan elektron, +2 da daje dva, i tako dalje.
Ovo radi uglavnom za ionski spojevi, u kovalentnim vezama, iako je interpretacija slična, nije ista jer te veze dijele elektrone. U tim spojevima govorimo o više elektronegativnih elemenata, koji povlače veći dio elektroničkog para i ostaju s negativnijim nabojem, ovisno o broju elektrona koje privlači. To se može vidjeti u Lewisove formule.
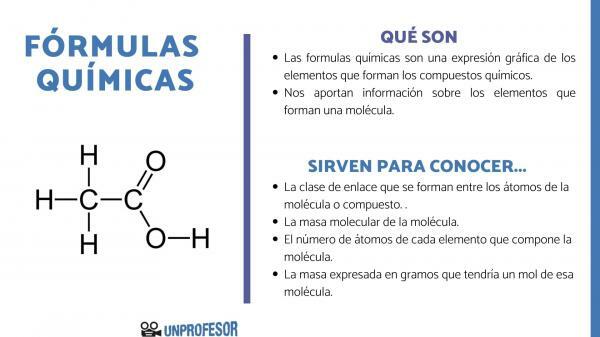
Ako želite znati čemu služe kemijske formule, morate uzeti u obzir da nam ovaj broj omogućuje dobivanje nekih informacije o molekuli, kao što su:
- The link klasa koji nastaju između atoma molekule ili spoja. Ove veze su normalno kovalentne kada u njima sudjeluju nemetalni i ionski atomi ako su to metalne i nemetalne veze.
- The molekularne mase molekule.
- The broj atoma svakog elementa koji čini molekulu. Ponekad se naziva centezimalnim sastavom molekule.
- Masa izražena u grama koji bi imao jedan mol te molekule.
U slučaju ionskog spoja, na primjer natrijevog klorida ili obične soli, nije striktno točno govore o molekulama (iako se to ponekad radi), da one imaju tendenciju formiranja velikih agregata i makromolekule. U ovom slučaju, formula spoja pomaže nam vidjeti koji ga ioni tvore i u kojoj količini.
