Mire szolgál az IDŐSZAKOS TÁBLÁZAT?
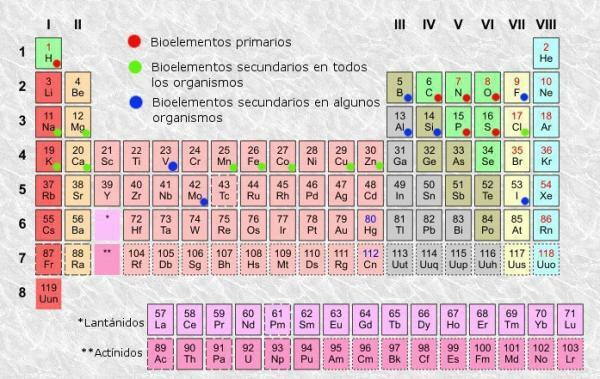
A periódusos rendszer az atomelemek osztályozási rendszere, amelyet 1869-ben talált ki az orosz vegyész Dmitri Mendelejevet, később más vegyészek átszervezték és frissítették, amíg megjelenéséig nem érkezett jelenlegi. Annak ellenére, hogy a történelem során hasznosnak bizonyult eszköz (ezért továbbra is használják és frissítik), a olyan unalmas tanulni és megérteni, ezért mindannyian feltettük magunknak a kérdést: "Mire szolgál az asztal? időszakos? ".
Ha tudni akarod mire szolgál a periódusos rendszer és miért fontos megérteni annak tulajdonságait, olvassa tovább ezt a leckét egy TANÁRTÓL.
Index
- A periódusos rendszer osztályozása
- Egy elem nevének vagy szimbólumának megkeresése a periódusos rendszer segítségével
- Ismerje egy elem atomtömegét
- Ismerje egy elem atomszámát
- Megjósolni egy elem atomsugarát
- Hasonlítsa össze két elem ionizációs energiáját
- Kémiai elem elektronegativitásának megkeresése
- Hasonlítsa össze két elem elektron-affinitását
A periódusos rendszer osztályozása.
Mint minden táblázatban, itt is a periódusos rendszer az elemek közül megkülönböztethetünk oszlopokat (függőleges) és sorokat (vízszintesen). A periódusos rendszerben 18 oszlop vagy csoport és 7 sor vagy periódus található.
Ezenkívül képes lesz arra, hogy ellenőrizze, hogy általában a táblázat minden mezőjében legalább a következő információk jelennek meg:
- Kémiai elem szimbólum: az elemek azonosítására használt rövidítések vagy jelek. Általában egy vagy két betűből állnak, amelyek közül az első mindig nagybetűs.
- Kémiai elem neve: a kémiai elem neve, amely megfelel a felső rövidítésnek. Általában a szimbólum alatt van.
- Atomszám: az adott elem egyes atomjainak összes protonja. Általában az elem dobozának bal felső sarkában (vagy a teljesebb táblázatok jobb felső sarkában) jelenik meg.
- Atomtömeg: Az atom tömege általában a protonok és a neutronok teljes tömegének tekinthető egyetlen atomban. A legegyszerűbb táblákban az elem neve alatt van elrendezve, bár másokban az elem mezőjének jobb felső részén jelenhet meg.
Vannak periódusos táblázatok, amelyek egyéb összetettebb és specifikusabb információkat tartalmaznak, mint pl oxidációs állapotok (hasznos például kémiai vegyületek megfogalmazásakor), ionizációs energia, elektronegativitás stb., de az alap periódusos táblázatok általában adjon elegendő információt, és általában elegendő az átlagos felhasználó számára, aki ebből megtudhatja az olyan információkat, mint amilyeneket alább elmondunk.

A periódusos rendszer segítségével megtudhatja egy elem nevét vagy szimbólumát.
Néha ismerjük a kémiai elem szimbólum de nem tudjuk a nevét. Máskor ismerjük a kémiai elem neve, de rövidítése vagy szimbóluma nem. Valójában nagyon könnyű, hogy valaha ez történt veled az órán.
Ezekben az esetekben igénybe vehetünk egy periódusos rendszert, anélkül, hogy komplex lenne, és gyorsan és pontosan megkereshetjük a hiányzó adatokat.
Ismerje egy elem atomtömegét.
Néha ismerjük a kémiai elemet, amellyel foglalkozunk, de tudnunk kell atomtömeg, vagyis mennyi az adott atom atomja.
Ezek az információk hasznosak lehetnek például a következő feladatok végrehajtása során:
- Számítsa ki az anyag konkrét mennyiségét.
- Elemezze a tesztekben vagy kísérletekben elért eredményeket.
- Számítsa ki a tömeg százalékát.
- Értse meg a komplex molekulák pontos moláris tömegét.
Ismerje egy elem atomszámát.
Az atomszám az egy elem atomjának összes protonja. A kationtól eltérő, elektromosan semleges atomban (pozitív töltésű, egy elektronnal kevesebb a normál állapotnál) vagy anion (negatív töltésű, normál állapotánál egynél több elektronnal rendelkezik), a protonok száma megegyezik az elektronok.
A protonok száma a döntő tényező, amikor meg kell különböztetni az egyik elemet a másiktól, mivel az elektronok vagy a neutronok száma nem változtatja meg az elem típusát.

Megjósolni egy elem atomsugarát.
Az atomsugár ugyanazon elem két atomjának középpontja közötti távolság fele, amelyek alig érintik egymást. Ebben az esetben ismerje a egy kémiai elem helyzete a periódusos rendszerben Ez segíthet abban, hogy megtudjuk annak hozzávetőleges atomsugarát, vagy összehasonlítsuk egy másik elemmel. Ehhez tudnunk kell az atom sugara:
- Növekszik, amikor a periódusos rendszer tetejéről lefelé haladunk.
- Leereszkedik, amikor a periódusos rendszerben balról jobbra haladunk.
Ily módon a kalcium kisebb, mint a rubídium, de nagyobb, mint a vas.
Tudj meg többet Mi az atom sugara ezzel a másik video leckével egy tanítótól.
Hasonlítsa össze két elem ionizációs energiáját.
A ionizációs energia az a az elektron eltávolításához szükséges energia az elem atomjából. Ebben az esetben, ha ismerjük két elem helyzetét a periódusos rendszerben, akkor tudjuk, melyik elem lesz könnyebb "eltávolítani" egy elektront. Csak azt kell figyelembe vennünk, hogy:
- Az ionizációs energia csökken, amikor a periódusos rendszerben felfelé és lefelé mozog.
- Az ionizációs energia nő, amikor a periódusos rendszer balról jobbra halad.
A berillium és az oxigén között az oxigénnek több ionizációs energiája van. Ha összehasonlítjuk az oxigént és a ként, amely ugyanabban a csoportban van, de a következő időszakban, akkor az oxigénnek magasabb az ionizációs energiája is, mivel magasabb a periódusos rendszerben.
Keresse meg egy kémiai elem elektronegativitását.
Elektronegativitás az a egy atom képessége az elektronok vonzására. A gyakorlatban ez azt jelenti, hogy képes kémiai kötést kialakítani. Annak megismeréséhez, hogy egy kémiai elem nagy kapacitással képes-e kémiai kötést kialakítani, vagy sem, csak a periódusos rendszerben szereplő mintát kell figyelembe vennünk, vagyis:
- Le és lefelé haladva ereszkedik le.
- Balról jobbra haladva nő.
Az előző esethez hasonlóan az oxigén elektronegatívabb, mint a berillium és a kén, mivel jobbra van, mint az első, és magasabb, mint a kén.

Hasonlítsa össze két elem elektron-affinitását.
A Elektronikus affinitás ő energiaváltozás, amelyen egy semleges atom akkor megy át, amikor vonzza az elektront negatív iondá válni. Ebben az esetben az elektronikus affinitás nem változik pontosan úgy, mint az előző esetekben, bár elmondhatjuk, hogy általában az elektronikus affinitás:
- Ugyanebben az időszakban balról jobbra emelkedik.
- Menjen fel, ugyanabban a csoportban, alulról felfelé.
Ha további hasonló cikkeket szeretne olvasni Mire szolgál a periódusos rendszer?, javasoljuk, hogy adja meg a Az atom.
Hivatkozások
Van valami észrevétele vagy észrevétele a periódusos rendszer felhasználásával kapcsolatban? Nyugodtan hagyja megjegyzés rovatunkban! Tetszett ez a cikk? Értékelését alább is hagyhatja!



