מבנה האטום ומאפייניו

תמונה: SlidePlayer
אטומים הם חלק מהעולם שלנו. כל החומר עשוי מאטומים, ולכן חשוב להבין טוב יותר ממה הם מורכבים ומהם תפקידיהם. בשיעור זה ממורה אנו אומרים לך מה מבנה אטום ומאפיינים. אם אתה רוצה לדעת יותר על החלקיקים המרכיבים את כל החומר, המשך לקרוא מאמר זה.
אינדקס
- מהם אטומים?
- מבנה האטום
- המאפיינים העיקריים של האטום
- מהם איזוטופים?
- כיצד נמצאים האטומים בטבע?
מהם אטומים?
ה אָטוֹם זה היחידה הקטנה ביותר שאליה ניתן לחלק חומר מבלי לאבד את תכונותיו הכימיות, כלומר את תכונותיו כאלמנט כימי. האטום הוא המקור לכל מה שאפשר לראות או לגעת בו, מהכוכבים ועד ארוחת הבוקר שלך הבוקר.
אם נניח בצד את אובדן התכונות הכימיות שלו, נוכל לומר שהאטום מורכב מחלקיקים שונים, הנקראים חלקיקים תת-אטומיים. ישנם שלושה סוגים של חלקיקים תת אטומיים -פרוטונים, נויטרונים ואלקטרונים- עם מאפיינים שונים.
חלקיקים אלה מקובצים במספרים שונים ליצירת היסודות הכימיים (חמצן, פחמן וכו '), אך הם תמיד יופצו בעקבות מבנה קבוע.

תמונה: אתרי גוגל
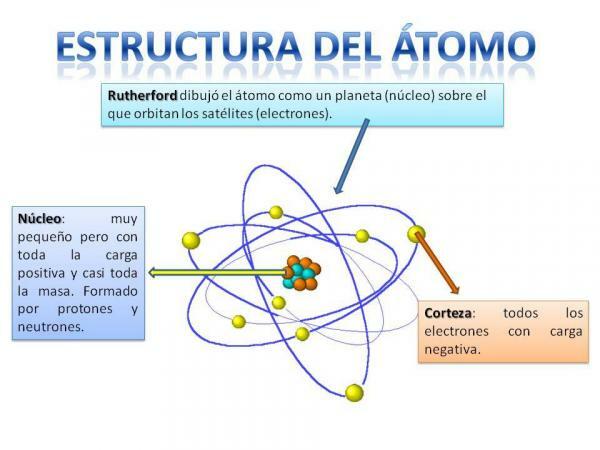
מבנה האטום.
מבנה האטום קבועכלומר, יכולים להיות לנו סוגים שונים של אטומים (אטום המימן, אטום החמצן וכו ') אך החלקיקים התת אטומיים שלהם מסודרים תמיד באופן דומה למערכת פלנטרית.
בוודאי תזכרו כיצד מערכת השמש מאורגנת: השמש במרכז וסביבתה מכאן כוכבי הלכת מסתובבים ומתארים מסלולים שונים, חלקם קרובים יותר ואחרים מרוחקים יותר שמש. במקרה של אטומים, במרכז הוא הליבה, עם צורה הדומה לאוכמניות והוא מורכב מה- נויטרונים וה פרוטונים.
סביב הליבה נמצא ה קליפת המוח שהוא האזור דרכו ה- אלקטרונים. בעבר חשבנו כי אלקטרונים מתארים מסלולים מסוימים, בדומה למצבם של כוכבי הלכת, אם כי כעת יודע שמסלולים אלה אינם מוגדרים כל כך טוב והם דומים יותר לאזורים בהם אנו נוטים יותר למצוא את עצמנו אלקטרונים.
תמונה: REA - תוכנית סייבל
המאפיינים העיקריים של האטום.
כדי להמשיך בשיעור זה על מבנה האטום ומאפייניו, חשוב להתמקד באלמנטים שגורמים לאטום להיחשב ככזה.
ולשם כך עלינו לענות על שאלה זו: מדוע כל האטומים מחליטים להזמין את עצמם בצורה מסוימת זו? התשובה היא פשוטה: היא נובעת מ- כוחות משיכה חשמליים. גרעין האטום מורכב מנויטרונים שאין להם מטען חשמלי ומפרוטונים שיש להם מטען חשמלי חיובי. ולאלקטרונים יש מטען חשמלי שלילי, ולכן יש כוח משיכה דומה בין הגרעין לאלקטרונים מיוצר בין שני הקטבים של מגנט אך אינו מספיק חזק כדי שאלקטרונים "יפלו" אל ה הליבה.
זה מובן יותר אם ניקח בחשבון את גודל הליבה: אם לאטום היה למשל מימד של אצטדיון כדורגל, היה לגרעין ממד הכדור במרכז מהשדה כמה כוח אטרקטיבי כדור הכדורגל יצטרך לגרום ליציעי האצטדיון ליפול עליו!
הפונקציה של נויטרונים
עכשיו אתם אולי תוהים, ואיזה תפקיד ממלאים הנויטרונים? למרות שאין להם מטען חשמלי, לנויטרונים יש תפקיד גדול בתוך האטום: הם תורמים 99% מהמסה. אם זה עוזר לך לזכור, אנו יכולים לומר כי אטום הוא כמו כנופיה של שלושה חברים: הכבד נויטרון, הפרוטון החיובי והאלקטרון השלילי, שמסתובב סביב הנויטרון ו אֶלֶקטרוֹן.
תנועת האלקטרונים
בשלב זה אני רוצה שנחזור למשהו שהשארנו בארגז הדיו: המסלולים שהאלקטרונים מתארים סביב הגרעין. אמרנו את זה אלקטרונים סובבים סביב הגרעין כפי שעושים כוכבי הלכת סביב השמש, חלקם קרובים יותר מאחרים, מדוע הם עושים זאת? אלקטרונים מסתובבים בקליפה כזו או אחרת בהתאם לאנרגיה שיש להם להתרחק מהגרעין, כלומר לאותם אלקטרונים הקרובים יותר לגרעין אין כוח מספיק כדי להתרחק מהגרעין בעוד שבשכבות החיצוניות (האורביטליות) של הקרום יש יותר אנרגיה והצליחו להתרחק יותר מהגרעין. הליבה. יתר על כן, בכל אחד מהמסלולים יש קיבולת מרבית של 8 אלקטרונים (חוק האוקטט).
חלקיקי האטום
אנו חוזרים לגישה אחרת שעשינו בעבר אך לא הסברנו: אטומים מורכבים ממנה נויטרונים, פרוטונים ואלקטרונים, המשלבים תמיד בעקבות אותו מבנה של גרעין וקרום, אך הם עושים זאת במספרים שונים כדי ליצור את היסודות הכימיים השונים. איך נוכל להשיג את היסודות הרבים המשלבים 3 סוגים של חלקיקים בלבד? היסודות הכימיים שראיתם מיוצגים אי פעם בטבלה המחזורית מאופיינים בכך שהם בעלי מספר אטומי מסוים.
ה מספר אטומי (Z) זה מספר לנו את מספר הפרוטונים בגרעין של אטום מסוג זה, השווה למספר האלקטרונים בתנאים רגילים. כך, למשל, כל האטומים שיש להם 6 פרוטונים (Z = 6) יהיו אטומי פחמן, והם יהיו בעלי אותם תכונות כימיות; האטומים עם 5 פרוטונים (Z = 5) יהיו אטומי בורון, בעלי תכונות כימיות זהות זה לזה ושונות מאלו של אטומי פחמן. אתה לא צריך לבלבל בין מספר אטומי למשקל אטומי או מספר מסה (A), שהוא סכום המשקל של נויטרונים ופרוטונים (משקל האלקטרונים זניח ביחס למשקל הגרעין הכולל).

תמונה: SlidePlayer
מהם איזוטופים?
בטבע אנו יכולים למצוא "תת-סוגים" שונים של אלמנטים, ה- איזוטופים. אני בטוח שבשלב מסוים שמעת על פחמן 14, איזוטופ רדיואקטיבי של פחמן המשמש לקביעת, בין היתר, את גיל המאובנים. איזוטופים הם שני אטומים עם מספר זהה של פרוטונים (אותו מספר אטומי), אך מספר שונה של נויטרונים, (מסה אטומית שונה). האיזוטופים של אותו יסוד נקראים בדרך כלל עם שם היסוד ואחריו המסה האטומית שלו.
בדוגמה שלנו, שני האיזוטופים הם פחמן, ולכן יש להם מספר אטומי של 6 (Z = 6) אבל לפחמן 12 (פחמן "רגיל") יש משקל אטומי של 12 לעומת המשקל האטומי של פחמן 14 14. האיזוטופים של אותו יסוד הם בעלי תכונות כימיות ופיזיקליות דומות מאוד. במקרה של פחמן 14, בניגוד לפחמן 12, זהו איזוטופ רדיואקטיבי הקיים בכל היסודות המכילים פחמן, כולל יצורים חיים.
ובכך אנו מסיימים שיעור זה על מבנה האטום ומאפייניו. אנו מקווים שזה עזר לך.

תמונה: המשימות שלך
כיצד נמצאים האטומים בטבע?
ניתן למצוא אטומים בבידוד, אך הדבר הנורמלי ביותר הוא למצוא אותם משולב בקבוצות שקוראים לו מולקולות.
מולקולות יכולות להיות מורכבות מאטומים מאותו יסוד (כגון מולקולת החמצן, המורכבת משני אטומים של חמצן) או לפי קבוצות עם אטומים של יסודות שונים (שני אטומי מימן ואחד של חמצן יוצרים את המולקולה של מים). קבוצות אלמנטים אלה נקראות מולקולות, אשר בתורן ניתן לשלב זו עם זו ו יוצרים קבוצות מורכבות יותר ויותר בהתאם לתגובתיות שלהן ולזיקה הכימית שלהן מקור של קישורים כימיים.
אם אתה רוצה לקרוא מאמרים נוספים הדומים ל- מבנה האטום ומאפייניואנו ממליצים לך להיכנס לקטגוריה שלנו האטום.



