原子の構造と特徴

画像:SlidePlayer
原子は私たちの世界の一部です。 すべての物質は原子でできているので、それらが何で構成され、それらの機能が何であるかをよりよく理解することが重要です。 教師からのこのレッスンでは、 原子の構造と特徴. すべての問題を構成する粒子についてもっと知りたい場合は、この記事を読み続けてください。
インデックス
- 原子とは何ですか?
- 原子の構造
- 原子の主な特徴
- 同位体とは何ですか?
- 原子は自然界でどのように発見されていますか?
原子とは何ですか?
ザ・ 原子 それは 物質を分割できる最小単位 その化学的性質、つまり化学元素としての性質を失うことなく。 原子は、星から今朝の朝食まで、見たり触れたりできるすべてのものの起源です。
化学的性質の喪失を除けば、原子は亜原子粒子と呼ばれるさまざまな粒子で構成されていると言えます。 亜原子粒子には3つのタイプがあります -陽子、中性子、電子- さまざまな特性を持つ。
これらの粒子は、化学元素(酸素、炭素など)を形成するためにさまざまな数でグループ化されますが、常に固定構造に従って分布します。

画像:Googleサイト
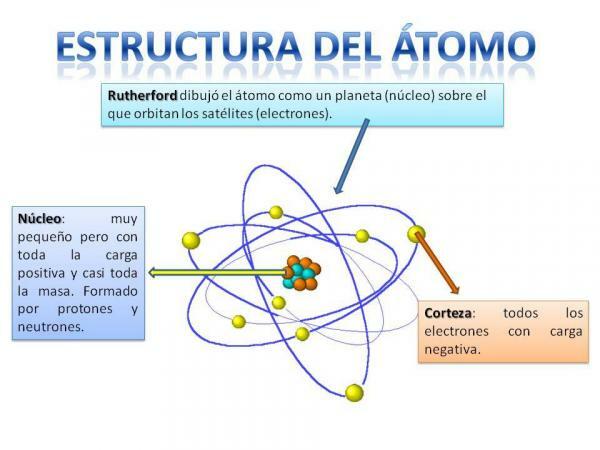
原子の構造。
原子の構造は固定されていますつまり、さまざまな種類の原子(水素原子、酸素原子など)を持つことができますが、それらの亜原子粒子は常に惑星系と同じように編成されています。
あなたは確かに太陽系がどのように組織されているかを覚えているでしょう:太陽は中心と周りにあります これから、惑星はさまざまな軌道を描いて回転し、いくつかはより近く、他はより遠くにあります。 太陽。 原子の場合、中央にあるのは 芯、ブラックベリーに似た形で、 中性子 そしてその 陽子.
コアの周りは 皮質 これは、 電子. 以前は、電子は惑星と同じように特定の軌道を描いていると考えられていましたが、現在は これらの軌道はあまり明確に定義されておらず、私たちが自分自身を見つける可能性が高い領域に似ていることを知っています 電子。
画像:REA-Plan Ceibal
原子の主な特徴。
原子の構造と特性に関するこのレッスンを続けるには、原子をそのように見なす要素に焦点を当てることが重要です。
そしてこのために、私たちはこの質問に答えなければなりません:なぜすべての原子がその特定の方法で自分自身を順序付けることを決定するのですか? 答えは簡単です:それは
電気引力. 原子核は、電荷を持たない中性子と、正電荷を帯びた陽子で構成されています。 電子は負の電荷を持っているので、原子核と電子の間には同様の引力があります 磁石の2つの極の間に生成されますが、電子が「落下」するのに十分な強度ではありません。 芯。これを考慮に入れると、よりよく理解できます。 コアサイズ:原子が、たとえばサッカースタジアムの寸法を持っている場合、核は中央にボールの寸法を持ちます。 フィールドからサッカーボールがスタジアムの観覧席に落ちるには、どれだけの魅力的な力が必要になるでしょう。
中性子の機能
今、あなたは疑問に思うかもしれません、そして中性子はどのような役割を果たしますか? 電荷を持たないにもかかわらず、中性子は原子内で大きな役割を果たします。中性子は質量の99%を占めます。 それがあなたが覚えているのを助けるならば、私たちは原子が3人の友人のギャングのようなものであると言うことができます:重い 中性子、正の陽子と負の電子、それは中性子と 電子。
電子の動き
この時点で、インク溜めに残したもの、つまり電子が原子核の周りを描く軌道に戻りたいと思います。 私たちはそれを言っていました 電子は原子核の周りを回転します 惑星が太陽の周りをしているように、いくつかは他よりも近くにありますが、なぜ彼らはそれをしているのですか? 電子は、原子核から離れる必要があるエネルギーに応じて、あるシェルまたは別のシェルで回転します。つまり、原子核に近い電子には、 地殻の最外層(軌道)にあるものはより多くのエネルギーを持ち、原子核からさらに離れることができている間、原子核から離れるのに十分な力。 芯。 さらに、各軌道には最大8個の電子の容量があります(オクテット則).
原子の粒子
以前に行ったが説明していない別のアプローチに戻ります。原子はで構成されています 中性子、陽子、電子、これは常に核と地殻の同じ構造に従って結合しますが、異なる数で結合して異なる化学元素を形成します。 3種類の粒子だけを組み合わせた多くの要素をどのように取得できますか? 周期表に表示されている化学元素は、特定の原子番号を持っているという特徴があります。
ザ・ 原子番号(Z) これは、このタイプの原子の核内の陽子の数を示します。これは、通常の条件下での電子の数と同じです。 したがって、たとえば、6つの陽子(Z = 6)を持つすべての原子は炭素原子になり、同じ化学的性質を持ちます。 5つの陽子(Z = 5)を持つ原子は、互いに同じ化学的性質を持ち、炭素原子の化学的性質とは異なるホウ素原子になります。 原子番号と原子量を混同する必要はありません。 質量数(A)、これは中性子と陽子の重量の合計です(電子の重量は全原子核の重量に対して無視できます)。

画像:SlidePlayer
同位体とは何ですか?
自然界では、要素のさまざまな「サブタイプ」を見つけることができます。 同位体. ある時点で、化石の年代を決定するために使用される炭素の放射性同位体である炭素14について聞いたことがあると思います。 同位体は 陽子の数が同じ2つの原子 (同じ原子番号)が、異なる数の中性子(異なる原子量)。 同じ元素の同位体は通常、元素の名前の後にその原子量が続く名前が付けられます。
この例では、両方の同位体が炭素であるため、原子番号は6(Z = 6)ですが 炭素12(「通常の」炭素)の原子量は12であるのに対し、炭素14の原子量は 14. 同じ元素の同位体は、非常に類似した化学的および物理的特性を持っています。 炭素14の場合、炭素12とは異なり、生物を含む炭素を含むすべての元素に存在するのは放射性同位元素です。
これで、原子の構造と特性に関するこのレッスンを終了します。 お役に立てば幸いです。

画像:あなたのタスク
原子は自然界でどのように発見されていますか?
原子は孤立して見つけることができますが、最も普通のことはそれらを見つけることです グループで組み合わせる と呼ばれる 分子.
分子は、同じ元素の原子で構成できます(酸素分子など、次の2つの原子で構成されます)。 酸素)または異なる元素の原子を持つグループ(水素の2つの原子と酸素の1つが 水)。 これらの要素のグループは分子と呼ばれ、分子は互いに組み合わせることができ、 それらの反応性およびそれらの化学親和力に従って、異なるますます複雑なグループを形成する のソース 化学リンク.
に似た記事をもっと読みたい場合 原子の構造と特徴、次のカテゴリに入力することをお勧めします 原子.