მოელერის დიაგრამა: რა არის ეს, როგორ გამოიყენება ქიმიაში და მაგალითები
ქიმია შეიძლება განსაკუთრებით რთული იყოს, ამიტომ მისასალმებელია ნებისმიერი ინსტრუმენტი, რომელიც ხელს უწყობს სწავლას მათთვის, ვინც მას ეცნობა.
მადელუნგის წესისა და ატომების ელექტრონული კონფიგურაციის გაცნობის ერთ-ერთი ყველაზე პოპულარული მეთოდია. მოელერის დიაგრამა, გრაფიკული მნემონიკური წესი, რომელიც აადვილებს იმის დანახვას, რომელ ორბიტალებში ელექტრონები.
შემდეგი ჩვენ ვაპირებთ აღმოვაჩინოთ რისგან შედგება მოლერის დიაგრამაროგორ უკავშირდება ის მადელუნგის წესს, როგორ გამოიყენება რამდენიმე ამოხსნილი მაგალითის საშუალებით და რომელი ქიმიური ელემენტები არ ემორჩილება ამ სტრატეგიას.
- დაკავშირებული სტატია: "ქიმიური ბმის 5 ტიპი: ასე შედგება მატერია"
რა არის მოლერის დიაგრამა?
მოელერის დიაგრამა, რომელიც ასევე ცნობილია როგორც წვიმის მეთოდი ან დიაგონალების წესი, არის მადელუნგის წესის შესწავლის გრაფიკული და მნემონიკური მეთოდი, ქიმიური ელემენტების ელექტრონული კონფიგურაციის ცოდნისა და ჩაწერის ტექნიკა.
ამ დიაგრამას ახასიათებს დიაგონალების დახატვა ორბიტალების სვეტებში, ზემოდან ქვემოდან მარჯვნიდან მარცხნივ. მოელერის სქემის მეშვეობით განისაზღვრება ორბიტალების შევსების რიგი, რომელიც განისაზღვრება სამი კვანტური რიცხვით: n, l და ml.
მოელერის დიაგრამა მუშაობს შემდეგნაირად:

თითოეული სვეტი შეესაბამება სხვადასხვა ორბიტალს, რომლის მეშვეობითაც ატომის ელექტრონები ცირკულირებენ, სუბატომური ნაწილაკები, რომლებსაც აქვთ უარყოფითი მუხტი. განსახილველი ორბიტალებია: s, p, d და f, თითოეულს აქვს სპეციალური სივრცე ელექტრონების დასაბინავებლად და, შესაბამისად, სხვადასხვა ენერგეტიკული დონეებით..
თუ დიაგონალებს ან ისრებს დავხატავთ ზემოაღნიშნული გაგებით, მივიღებთ, რომ პირველი ორბიტალი არის 1s. მეორე ისარი იწყება 2s ორბიტალით. მესამე ისარი კვეთს 2p და 3s. მეოთხე დიაგონალი არის 3p და 4s. მეხუთე დიაგონალი არის 3d, 4p და 5s და ასე შემდეგ. მოელერის დიაგრამა არის შესავალი ტექნიკა მათთვის, ვინც იწყებს პერიოდული ცხრილის ელემენტების ელექტრონული კონფიგურაციების შესწავლას ქიმიაში.
- შეიძლება დაგაინტერესოთ: "საბუნებისმეტყველო მეცნიერებების 6 ძირითადი დარგი"
მადელუნგის წესი
მოელერის დიაგრამიდან გამომდინარე არის მადელუნგის წესის გრაფიკული გამოსახულება (ზოგიერთ ქვეყანაში ასევე ცნობილია როგორც კლეჩკოვსკის მმართველობა) ჯერ უნდა ვიცოდეთ რაზეა საუბარი. ამ წესის მიხედვით, ატომის ორბიტალების შევსება უნდა ემორჩილებოდეს შემდეგ ორ წესს:
მადელუნგის პირველი წესი
ჯერ ივსება ორბიტალები n + l ყველაზე დაბალი მნიშვნელობებით, n არის ძირითადი კვანტური რიცხვი, ხოლო l არის ორბიტალური კუთხური იმპულსი..
მაგალითად, 3d ორბიტალი შეესაბამება n = 3 და l = 2. ამიტომ, n + l = 3 + 2 = 5. ამის ნაცვლად, 4s ორბიტალი შეესაბამება n = 4 და l = 0, შესაბამისად n + l = 4 + 0 = 4. აქედან დგინდება, რომ ელექტრონები ავსებენ 4s ორბიტალს ჯერ 3d-მდე, რადგან 4s = 4, ხოლო 3d = 5.
- დაკავშირებული სტატია: "ქიმიური რეაქციების 11 ტიპი"
მადელუნგის მეორე წესი
თუ ორ ორბიტალს აქვს იგივე მნიშვნელობა n + l, ელექტრონები ჯერ დაიკავებენ ერთს, რომელსაც აქვს n-ის ქვედა მნიშვნელობა..
მაგალითად, 3d ორბიტალს აქვს n + l = 5 მნიშვნელობა, იდენტურია 4p ორბიტალის (4 + 1 = 5), მაგრამ, რადგან 3d ორბიტალს აქვს ყველაზე დაბალი მნიშვნელობა n-ისთვის, ის პირველი შეივსება ვიდრე 4p ორბიტალი.
ყველა ამ დაკვირვებისა და წესიდან გამომდინარე, ატომური ორბიტალების შევსებისას შეიძლება მივიღოთ შემდეგი თანმიმდევრობა: 1s 2s 2p 3s 3p 4s 3d 4p. მიუხედავად იმისა, რომ ეს თანმიმდევრობა ფიქსირდება, მისი ზეპირად დამახსოვრება რთულია, რის გამოც არსებობს მოელერის დიაგრამა, რომელიც გრაფიკულად ასახავს მის წესრიგს.
- შეიძლება დაგაინტერესოთ: "დალტონის ატომური თეორიის 9 პოსტულატი"
ნაბიჯები, რომლებიც უნდა დაიცვათ მოლერის დიაგრამის გამოყენებისას
როგორც წინა ნაწილში ავღნიშნეთ, მადელუნგის წესი იყენებს ფორმულას n + l იმის დასადგენად, თუ რა ორბიტალები ივსება მანამდე და ამით განსაზღვრავს რა არის ელემენტის ელექტრონული კონფიგურაცია განსაზღვრული. თუმცა, მოელერის დიაგრამა უკვე წარმოადგენს ამას გრაფიკულად და მარტივად, ამიტომ საკმარისია მიჰყვეთ იმავე დიაგრამის სვეტები და დახაზეთ დიაგონალები, რათა გაარკვიოთ რა თანმიმდევრობით არის თითოეულის ორბიტალი ელემენტი.
ატომის ელექტრონული კონფიგურაციის გასარკვევად და რომელ ორბიტალებში მდებარეობს მისი ელექტრონები, ჯერ უნდა ვიცოდეთ მისი ატომური ნომერი Z.. რიცხვი Z შეესაბამება ატომში ელექტრონების რაოდენობას, სანამ ეს ატომი ნეიტრალურია, ანუ რაც იგივეა, რომ ის არ არის იონი, არც დადებითი (კატიონი) და არც უარყოფითი (ანიონი).
ამრიგად, თუ ვიცით Z ნეიტრალური ატომისთვის, ჩვენ უკვე ვიცით რამდენი ელექტრონი აქვს ჩვეულებრივ ამ ელემენტის ნეიტრალურ ატომს. ამის გათვალისწინებით დავიწყებთ მოელერის დიაგრამაზე დიაგონალების დახატვას. უნდა გავითვალისწინოთ, რომ ორბიტალის თითოეულ ტიპს აქვს ელექტრონების განთავსების განსხვავებული ტევადობა, რომლებიც არიან:
- s = 2 ელექტრონი
- p = 6 ელექტრონი
- d = 10 ელექტრონი
- f = 14 ელექტრონი
ის ჩერდება ორბიტალზე, სადაც Z-ის მიერ მოცემული ბოლო ელექტრონი იყო დაკავებული.
მოელერის დიაგრამის მაგალითები
იმისათვის, რომ უკეთ გავიგოთ, როგორ მუშაობს მოლერის დიაგრამა, ქვემოთ განვიხილავთ სხვადასხვა ელემენტების ელექტრონული კონფიგურაციის დაყენების რამდენიმე პრაქტიკულ მაგალითს.
ბერილიუმი
ნეიტრალური ბერილიუმის (Be) ატომის ელექტრონული კონფიგურაციის დასადგენად, პირველ რიგში უნდა მოვიძიოთ ის პერიოდულ სისტემაში. ტუტე დედამიწა, რომელიც მდებარეობს ცხრილის მეორე სვეტში და მეორე რიგში. მისი ატომური რიცხვია 4, შესაბამისად Z = 4 და მას ასევე აქვს 4 ელექტრონი.
ამ ყველაფრის გათვალისწინებით ვაპირებთ გამოვიყენოთ მოლერის დიაგრამა, რათა დავინახოთ როგორ მდებარეობს ამ ელემენტის 4 ელექტრონი. ვიწყებთ დიაგონალების ზემოდან ქვემოდან და მარჯვნიდან მარცხნივ ზემოაღნიშნული გაგებით.
როდესაც ჩვენ ვავსებთ ორბიტალებს, მიზანშეწონილია თითოეულ მათგანში აღმოჩენილი ელექტრონების რაოდენობა ზემოწერის სახით დააყენოთ. ვინაიდან 1s არის პირველი ორბიტალი და ის იკავებს ორ ელექტრონს, ჩვენ დავწერთ მას:

ვინაიდან ჯერ კიდევ გვაქვს თავისუფალი ელექტრონები, ვაგრძელებთ ორბიტალების შევსებას. შემდეგი არის 2s ორბიტალი და, როგორც 1s, ის იკავებს 2 ელექტრონს, შესაბამისად 2s2. რადგან ჩვენ უკვე გვაქვს ყველა ელექტრონი კარგად განლაგებული Be-ს ნეიტრალური ატომის ორბიტალებში, შეგვიძლია ვთქვათ, რომ ამ ელემენტის ელექტრონული კონფიგურაცია არის:

ჩვენ დავრწმუნდებით, რომ კარგად გავაკეთეთ ზედნაწერების დამატებით: 2 + 2 = 4
- შეიძლება დაგაინტერესოთ: "მოლეკულური კინეტიკური თეორია: მატერიის 3 მდგომარეობა"
მატჩი
ელემენტი ფოსფორი (P) არის არამეტალი, რომელიც გვხვდება პერიოდული ცხრილის მესამე მწკრივში და მე-16 სვეტში., Z = 15-ით, შესაბამისად მას აქვს სულ 15 ელექტრონი, რომლებმაც უნდა დაიკავონ ორბიტალები.
წინა მაგალითის ნახვის შემდეგ, ჩვენ შეგვიძლია წინსვლა ცოტათი და მისი 4 ელექტრონის პოვნა იმავე ორბიტალებში, რაც ბერილიუმს აქვს თავისი 4 ელექტრონისთვის, აკლია 9 ელექტრონი პლუს.

2s ორბიტალის შემდეგ შემდეგი დიაგონალი შედის 2p ორბიტალში და მთავრდება 3s ორბიტალთან. 2p ორბიტალს შეუძლია დაიკავოს 6 ელექტრონი, ხოლო 3s-ის შემთხვევაში მხოლოდ 2. ამრიგად, გვექნებოდა:
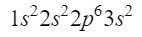
ამ დროისთვის ჩვენ გვაქვს 12 ელექტრონი კარგად განლაგებული, მაგრამ ჯერ კიდევ 3 გვაქვს გასავლელი. ჩვენ ვაკეთებთ სხვა დიაგონალს და ამჯერად შევდივართ 3p ორბიტალში მოელერის დიაგრამის მიხედვით, ორბიტალში, რომელსაც აქვს სივრცე 6 ელექტრონისთვის., მაგრამ რადგან ჩვენ მხოლოდ 3 ელექტრონი გვაქვს დარჩენილი, ეს ორბიტალი სრულად არ იქნება დაკავებული, ზედწერილად 3-ს დავაყენებთ. ამრიგად, ფოსფორის დასასრულებლად, მისი ელექტრონული კონფიგურაცია შემდეგია:

ჩვენ დარწმუნდებით, რომ კარგად გავაკეთეთ ზედნაწერების დამატებით: 2 + 2 + 6 + 2 + 3 = 15
ცირკონიუმი
ელემენტი ცირკონიუმი (Zr) არის გარდამავალი ლითონი, რომელიც ნაპოვნია მე-4 სვეტსა და მე-5 რიგში და აქვს Z = 40.. წინა მაგალითის გამოყენებით ბილიკის შეკვეცით, ჩვენ შეგვიძლია პირველი 18 ელექტრონის მდებარეობა.
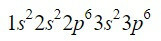
3p ორბიტალის შემდეგ, მომდევნოები, რომლებიც ივსება, მოელერის დიაგრამით გვიხელმძღვანელებს, არის 4s, 3d, 4p და 5s ორბიტალები, შესაბამისად 2, 10, 6 და 2 ელექტრონის ტევადობით.

დიაგრამაში პირველი ცხრა ორბიტალის დასრულება ჯამში 20 ელექტრონს ემატება. ტოვებს 2 დარჩენილ ელექტრონს, რომლებიც მოთავსებულია შემდეგ ორბიტალში, 4d. ამრიგად, ცირკონიუმის ნეიტრალური ელემენტის ელექტრონული კონფიგურაცია არის:
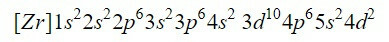
ჩვენ დარწმუნდებით, რომ კარგად გავაკეთეთ ზედნაწერების დამატებით: 2 + 2 + 6 + 2 + 6 + 2 + 10 + 6 + 2 + 2 = 40
ჟანგბადი
აქ ჩვენ ვხედავთ ოდნავ უფრო რთულ მაგალითს, რომელიც არის ჟანგბადი (O). ეს გაზი გვხვდება პერიოდული ცხრილის მე-16 სვეტსა და მე-2 მწკრივში, ის არის არალითონი და აქვს ატომური ნომერი 8.
ჯერჯერობით, სხვა მაგალითების გადახედვით, ვიფიქრებთ, რომ მისი Z = 8, თუმცა ეს არც ისე მარტივია, რადგან ეს გაზი განსაკუთრებული ხასიათისაა, თითქმის ყოველთვის არის იონის სახით, მუხტით -2.
ეს ნიშნავს, რომ მიუხედავად იმისა, რომ ნეიტრალურ ჟანგბადის ატომს აქვს 8 ელექტრონი, როგორც ეს მითითებულია მისი ატომური რიცხვით, მას აქვს მართალია, ბუნებაში მას აქვს მეტი, თავის შემთხვევაში 10 (8 ელექტრონი + 2 ელექტრონი ან თუ გნებავთ -8 მუხტი. ელექტრო -2).
ასე რომ, ამ შემთხვევაში, ელექტრონების რაოდენობა, რომლებიც უნდა განვსაზღვროთ ორბიტალებში, არის არა 8, არამედ 10 ელექტრონი, თითქოს ჩვენ ვპოულობთ ქიმიური ელემენტის ნეონის ელექტრონებს, რომელსაც აქვს Z = 10.
ამის გაგებით, ჩვენ მხოლოდ უნდა გავაკეთოთ იგივე, რასაც ვაკეთებდით წინა შემთხვევებში, მხოლოდ იმის გათვალისწინებით, რომ ჩვენ ვმუშაობთ იონთან (ანიონთან):
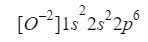
ჩვენ დავრწმუნდებით, რომ კარგად გავაკეთეთ ზედნაწერების დამატებით: 2 + 2 + 6 = 10
კალციუმი
ჟანგბადის მსგავსი რაღაც ემართება კალციუმს (Ca), მხოლოდ ამ შემთხვევაში საუბარია კატიონზე, ანუ იონზე დადებითი მუხტით..
ეს ელემენტი გვხვდება პერიოდული ცხრილის მე-2 მწკრივში 4, ატომური რიცხვით 20, თუმცა, ბუნება ჩვეულებრივ წარმოდგენილია იონის სახით დადებითი მუხტით +2, რაც ნიშნავს, რომ მისი ელექტრონული მუხტი არის 18 (- 20 + 2 = 18; 20 ელექტრონი - 2 ელექტრონი = 18 ელექტრონი).
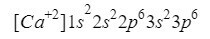
ჩვენ დარწმუნდებით, რომ კარგად გავაკეთეთ ზედნაწერების დამატებით: 2 + 2 + 6 + 2 + 6 = 18
გამონაკლისები მოლერის დიაგრამასა და მადელუნგის წესიდან
მიუხედავად იმისა, რომ მოელერის დიაგრამა ძალიან სასარგებლოა მადელუნგის წესის გასაგებად და იმის გასაგებად, თუ როგორ მდებარეობს სხვადასხვა ქიმიური ელემენტების ელექტრონები, სიმართლე ის არის, რომ ის არ არის უტყუარი. არის გარკვეული ნივთიერებები, რომელთა შემადგენლობა არ ემორჩილება იმას, რაც ჩვენ ავხსენით.
მათი ელექტრონული კონფიგურაციები ექსპერიმენტულად განსხვავდება მადელუნგის წესით ნაწინასწარმეტყველები კვანტური მიზეზების გამო.. ამ ელემენტებს შორის, რომლებიც არ შეესაბამება სტანდარტებს, გვაქვს: ქრომი (Cr, Z = 24), სპილენძი (Cu, Z = 29), ვერცხლი (Ag, Z = 47), როდიუმი (Rh, Z = 45), ცერიუმი ( Ce, Z = 58), ნიობიუმი (Nb; Z = 41), სხვათა შორის.
გამონაკლისები ძალიან ხშირია d და f ორბიტალების შევსებისას. მაგალითად, ქრომის შემთხვევაში, რომელსაც უნდა ჰქონდეს ვალენტური კონფიგურაცია, რომელიც მთავრდება 4s ^ 2 3d ^ 4 მოელერის სქემისა და მადელუნგის წესის მიხედვით, მას რეალურად აქვს 4s ^ 1 3d ^ 5 ვალენტური კონფიგურაცია. კიდევ ერთი უცნაური მაგალითია ვერცხლი, რომელსაც 5s ^ 2 4d ^ 9 ნაცვლად აქვს 5s ^ 1 4d ^ 10.

