Kaip gauti MASIKOS NUMERĮ?

Atomai yra viso materijos, sudarančio visatą, dalis. Materija yra labai įvairi, nes ją sudaro skirtingų tipų atomai, turintys skirtingas savybes ir savybes. Skirtingų atomų charakteristikas pateikia juos formuojančios dalelės: protonai, elektronai ir neutronai. Skirtingos proporcijos tarp vienos ir kitos yra apibrėžtos chemijoje su skirtingais pavadinimais (masės skaičius, atominis skaičius ir kt.). Masės skaičius nurodo galutinį arba bendrą dalelių skaičių branduolyje, arba kas yra tas pats sudaryti sumą tarp protonų ir neutronų, ir ji naudojama chemijoje atskirti elemento izotopus cheminis.
Šioje Dėstytojo pamokoje pamatysime masės numeris, kaip jį gauti, kas jis tiksliai yra ir kam jis naudojamas.
Indeksas
- Koks yra masės skaičius?
- Masės skaičius ir izotopai
- Kaip apskaičiuoti masės skaičių? - Formulė
Koks yra masės skaičius?
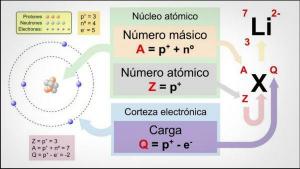
masės numeris tai ne kas kita, kaip protonų ir neutronų suma, tai yra visos dalelės, esančios branduolyje (atminkite, kad elektronai skrieja aplink branduolį, formuodami plutą).
Masės skaičius rašomas su raidė A ir jis nurodomas viršuje, visada kairėje nuo simbolio, kuris nurodo elementą, su kuriuo susiduriame. tai yra, jį rasime kaip nedidelį skaičių, kuris dedamas kairėje elemento simbolio, viršuje tai. Tai reiškia atomo masę, išmatuotą u.m.a (atominės masės vienetas), nes elektronų masė yra tikrai maža, ji yra tokia maža, kad ją galima nepaisyti arba nepaisyti.
Masinis atomų skaičius paprastai yra įpratęs diferencijuoti izotopus cheminio elemento.

Vaizdas: „Slideshare“
Masės skaičius ir izotopai.
Izotopai yra to paties cheminio elemento variantai, turintys skirtingą neutronų kiekį skiriasi masės skaičiumi. Izotopai gamtoje gali atsirasti paprastai (natūralūs izotopai) arba būti visiškai žmogaus sukurti (dirbtiniai izotopai). Izotopų gamtoje pavyzdžiai yra anglies:
Anglis atsiranda kaip trijų izotopų, kurių masės numeriai yra 12, 13 ir 14, mišinys: 12C, 13C ir 14C.
Izotopai turi daugybę paskirčių: jie naudojami gydant vėžį, nustatant nuodų išvaizdą audiniuose, pavyzdžiui, arseną, cheminių reakcijų žymenis ir kt.
Kiekvienas iš cheminio elemento izotopų gali turėti skirtingos savybės. Viena iš geriausiai žinomų ir dažniausiai naudojamų savybių yra pastovus pusinės eliminacijos laikas arba pusė gyvenimo. Izotopo pusinės eliminacijos laikas yra laikas, per kurį pradiniame radioizotopo mėginyje pusė branduolio suyra. Praktiškai izotopai linkę skaidytis, keisdamiesi iš mažiau stabilių formų į stabilesnes formas. stabilus, todėl tai taip pat gali būti suprantamas kaip laikas, kurio reikia, norint transformuoti ar transformuoti puse atomai radioaktyvus iš mėginio. Anglies-14, kuris tampa anglimi-12, pusinės eliminacijos laikas yra labai ilgas ir naudojamas senovinių organinių liekanų, tokių kaip fosilijos, datai. Priešingai, kitų izotopų, tokių kaip deguonis-15, pusinės eliminacijos laikas yra tik sekundės (tiksliau - 122 sekundės).
Vandenilio atveju jo natūralūs izotopai jie turi labai skirtingas savybes ir savybes, todėl jie turi tris skirtingus pavadinimus: įprastas vandenilis arba protium 1H, deuteris 2H (D) ir tritis 3H (T). Vandenilis turi ir kitų dirbtiniai izotopai (vandenilis-4, vandenilis-5 ir kt.).

Vaizdas: „Slideshare“
Kaip apskaičiuoti masės skaičių? - Formulė.
Tam, kad apskaičiuokite atomo ar jono masės skaičių mes turėsime pridėti atomo skaičių (protonų skaičių atome ar jone, paprastai vaizduojamus kaip „Z“) ir elektronų skaičių.
Masės skaičius (A) = atominis skaičius (Z) + neutronų skaičius (N)
Į = Z + N
Atomo skaičių galite rasti periodinėje elementų lentelėje, kiekvieno elemento viršutiniame kairiajame kampe. Taip pat masės skaičius arba atominė masė pasirodys po periodinės lentelės elementu.
Todėl atimdami atominį skaičių iš masės skaičiaus, galime žinoti ir protonų skaičių.
Neutronų skaičius (N) = masės skaičius (A) - atominis skaičius (Z)
N = A - Z
Pavyzdžiui, jei peržiūrėsite periodinę lentelę, pamatysite, kad geležies masės skaičius yra 55,84, ty A = 56, suapvalintas iki artimiausio vieneto; Jo atominis skaičius (Z) yra 26, taigi neutronų skaičius bus:
N = A - Z = 56-26 = 30
Jei norite perskaityti daugiau panašių į Kaip gauti masės skaičių?, rekomenduojame įvesti mūsų kategoriją Atomas.