Pozitīvu vai negatīvu IONU DEFINĪCIJA

Kā mēs jau zinām, atomi tos veido subatomiskās daļiņas. No trim subatomisko daļiņu veidiem tikai neitroniem nav elektriskā lādiņa. Tā vietā protoniem ir pozitīvs elektriskais lādiņš, bet elektroniem - negatīvs. Tikai elektroni, kas aizņem atoma perifēriju, var tikt pārnesti no viena atoma uz otru, savukārt kodola protoni uztur to skaitu stabilu. Šajā skolotāja stundā mēs redzēsim, kas notiek, kad atomi vai molekulas iegūst vai zaudē elektronus. Tas ir, mēs redzēsim pozitīvo vai negatīvo jonu definīcija un piemēri.
Indekss
- Kas ir joni? Viegla definīcija
- Jonu veidošanās: elektrofinitāte un elektronegativitāte
- Kas ir negatīvie joni? Ar piemēriem
- Kas ir pozitīvie joni? Ar piemēriem
Kas ir joni? Viegla definīcija.
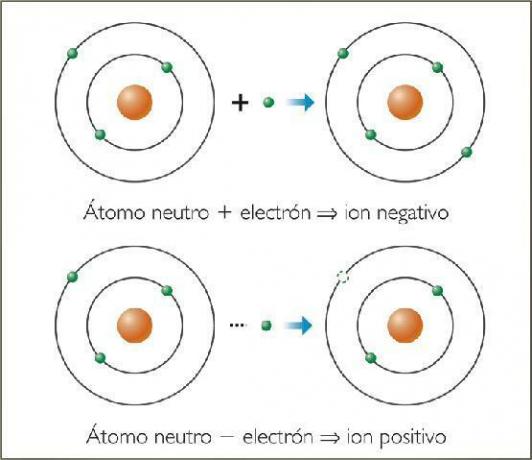
A jonu ir jebkura atoms vai molekula ar neto elektrisko lādiņu. Tas ir, tas ir atoms vai atomu kopa, kas ir savienoti kopā un kuru elektriskie lādiņi netiek kompensēti. Šī lādiņu dekompensācija notiek, kad viens vai vairāki elektroni pievienojas atomam vai atomu kopai vai atstāj to.
Joni tādējādi ir lādēti atomi vai molekulas, elektronu pieauguma vai zuduma dēļ (subatomiskās daļiņas ar negatīvu lādiņu un nenozīmīgu masu).
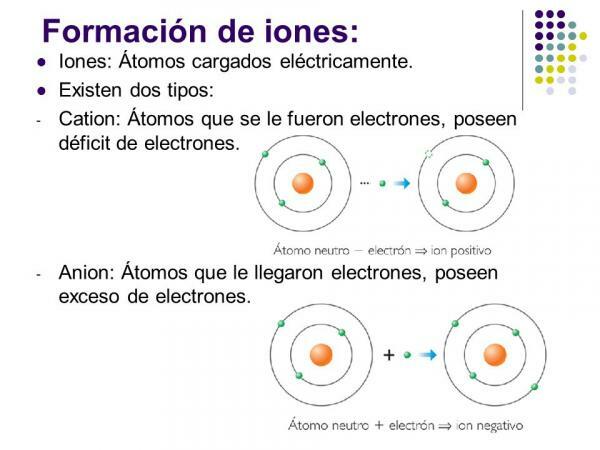
Jonu veidi: monatomiskie un polatomiskie
Ja ņemam vērā jonu sastāvu, izšķir divus veidus: monatomiskos jonus un polatomiskos jonus.
- Kā norāda nosaukums, monatomiskie joni tie, kurus veido a viens atoms.
- Jonu savienojumi o daudzatomu joni ir tie, kuros atomi ir kovalenti saistīti (saitē daloties vienam vai vairākiem elektronu pāriem), uzrādot vairākus neitroni molekulā, kas atšķiras no kopējā elektronu skaita.
- The daudzatomu joni tie parasti satur skābeklis un tiem parasti ir struktūra ar centrālo atomu, ap kuru ir sakārtoti atlikušie elementi, kas veido molekulu.
- The monatomisko jonu lādiņš no reprezentatīvajiem elementiem (tabulas 1. un 2. ģimene un periodiskās tabulas 13. līdz 17. ģimene) var viegli secināt, ja ir zināma to atrašanās vieta periodiskajā tabulā. Šajos gadījumos atomi iegūst vai zaudē elektronus, lai to valences apvalkā sasniegtu tā perioda cēlgāzes konfigurāciju (s2lpp6) vai kas ir tas pats, izpildiet okteta likums.
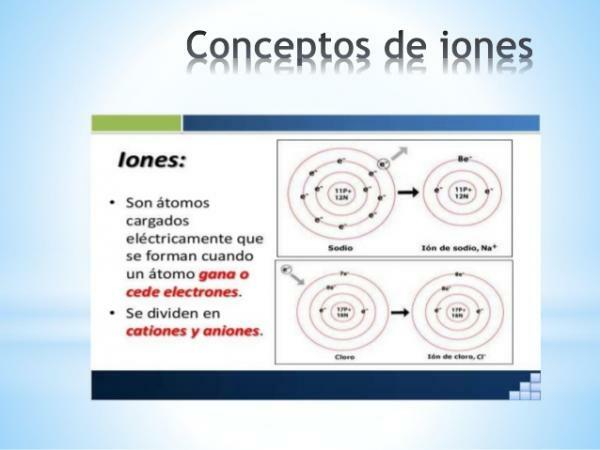
Attēls: Slideshare
Jonu veidošanās: elektroafinitāte un elektronegativitāte.
Atomu vai molekulu spēja veido jonus nosaka divas periodiskas īpašības: elektroafinitāte un elektronegativitāte. Abas īpašības laika gaitā palielinās un samazinās, kad mēs nolaižamies caur periodiskās tabulas grupu vai saimi.
The elektroafinitāte, ko sauc arī par elektronu afinitāti, ir atoma īpašība, kas tiek definēta kā atoma spēja piesaistīt elektronus. Savienojumu gadījumā līdzīgu īpašību sauc elektronegativitāte kas tiek definēta kā atoma spēja piesaistīt elektronus, kad tas veido saiti ar citu atomu. Abas īpašības tādējādi nosaka elementa tieksmi sagūstīt vai zaudēt elektronus.
Jonu saites
Cietā formā joni veido savienojumus vai jonu kristāli (sāļi), ko veido dažādu zīmju jonu kombinācija, kas savienoti kopā ar jonu saites. Vispazīstamākais šāda veida savienojumu piemērs ir parastais sāls (nātrija hlorīds: NaCl).
Jonu saite sastāv no dažādu zīmju jonu savienojumiem, izmantojot elektrostatiskos pievilcīgos spēkus (piesaiste starp pretējas zīmes lādiņiem). Šāda veida saitēs iejaucas elementi, kuru elektronegativitāte vai elektrofinitāte ir ļoti atšķirīga (metāla un nemetāla elementi). Vairumā gadījumu šie jonu savienojumi ir šķīst ūdenī un citi polārie šķīdinātāji.
Ūdens šķīdumos jonu savienojumi disociējas brīvajos jonos, kurus sauc elektrolīti, jo tā klātbūtne šķīdumā liek ūdenim izturēties kā elektriskajam vadītājam.
Kas ir negatīvie joni? Ar piemēriem.
The negatīvie joni Tos sauc anjoni. Visos gadījumos tie ir nemetālisko elementu vai molekulu atomi, kas satur nemetāliskus elementus. Šiem elementiem raksturīga ļoti augsta elektrofinitāte un elektronegativitāte. Tas ir, tie ir joni, kurus veido elementi ar augsta tieksme uztvert elektronus.
Monatomiskie anjoni: definīcija un piemēri
Tie ir nemetālisko elementu (periodiskās tabulas 13. līdz 17. grupa) atomi, kas ieguvuši vienu vai vairākus elektronus. Šiem anjoniem ir kopīga cēlgāzes elektroniskā struktūra (s)2lpp6) tā visattālākajā elektronu apvalkā (valences apvalks).
Piemēri:
- Hlorīda jons: Cl-
- Fluora jons: F-
- Jodīda jons:-
- Sulfīda jons: S-2
- Nitrīda jons: N-3
Poliatomiskie anjoni: definīcija un piemēri
Tie ir negatīvi lādēti joni, ko veido divi vai vairāki nemetālisko elementu atomi, kas savienoti ar kovalentām saitēm. Tie ir visizplatītākie daudzatomu joni. Visizplatītākie polatomiskie anjoni ir oksoanjoni, kas sastāv no centrālā nemetāliskā atoma un satur skābekli.
Parasti tos uzskata par ķīmiskiem savienojumiem, kas iegūti, kad skābs savienojums zaudē vienu vai vairākus protonus (H+). Šie daudzatomu anjoni var savā struktūrā saglabāt nedaudz ūdeņraža, kas viņiem piešķir noteiktu skābes raksturu (spēja atteikties no protoniem).
Piemēri:
- Nitrātu jons: NO3-
- Permanganāta jons: MnO4-
- Fosfāta jons: PO4-3
- Ūdeņraža karbonāta vai bikarbonāta jons: HCO3-
- Sulfīta jons: SO3-2
Attēls: Naturopathy
Kas ir pozitīvie joni? Ar piemēriem.
Tiek saukti pozitīvie joni ccijas. Gandrīz visos gadījumos tie ir metāla elementu vai molekulu atomi, kas satur metāla elementus. Šiem elementiem raksturīga ļoti zema elektrofinitāte un elektronegativitāte, tāpēc tiem ir skaidra tieksme zaudēt elektronus.
Monatomiskie katjoni: definīcija un piemēri
Tie ir joni ar pozitīvu lādiņu (elektronu zuduma dēļ), ko veido viens metāla elementa viens atoms. Šajā gadījumā katjonu veido elektronu zudums, kas ļauj elementam iztukšot tā visattālāko elektronisko slāni un iegūt cēlgāzes konfigurāciju (-s)2lpp6) no zemākā līmeņa. Tie ir visizplatītākais katjonu veids.
Piemēri:
- Ūdeņradis vai hidronu katjons (saukts arī par protonu): H+
- Nātrija katijons: Na+
- Dzelzs (III) katjons vai dzelzs katjons: Fe+3
- Kalcija katjons: Ca+2
- Vara (II) vai vara katijons: Cu+2
Poliatomiskie katijoni: definīcija un piemēri
Poliatomiskie katjoni ir tie, kurus veido divi vai vairāki atomi. Tie ir reti, visvairāk ir tā sauktie homopolitātiskie katjoni, kas satur vairāk nekā vienu tā paša elementa atoms trihidrogēna jonu gadījumā ir viena no visvairāk sastopamajām molekulām Visums. Poliatomiskie katijoni, ko veido dažādu elementu atomi, nav izplatīti, bet tos raksturo ūdeņraža klātbūtne, un tiek uzskatīts, ka tas rodas, kad bāzes savienojums uztver protonu (H+).
Piemēri:
- Amonija katijons: NH4+
- Oksonija katijons: HO3+
- Fosfonija katijons: PH3+
- Trihidrogēna katjons vai protonēts molekulārais ūdeņradis: H3+
- Dimercury katjons: Hg2+2
Attēls: planētas
Ja vēlaties izlasīt vairāk līdzīgus rakstus Negatīvie un pozitīvie joni: definīcija un piemēri, iesakām ievadīt mūsu kategoriju Atoms.
Bibliogrāfija
Alehandrina Gallego Pikó, Rosa Mª Garcinuño Martínez, Mª José Morcillo Ortega, Miguel Ángel Vaskquez Segura. (2018) Ķīmijas pamati. Madride: Uned



