Kam domāta PERIODISKĀ GALDA?
Periodiskā tabula ir atomu elementu klasifikācijas sistēma, kuru 1869. gadā izgudroja krievu ķīmiķis Dmitrijs Mendeļejevs un vēlāk citi ķīmiķi to reorganizēja un atjaunināja, līdz sasniedza savu izskatu pašreizējais. Neskatoties uz to, ka tas ir bijis līdzeklis, kas visā vēsturē ir izrādījies noderīgs (tāpēc to turpināja izmantot un atjaunināt), tas ir tik nogurdinoši mācīties un saprast, tāpēc mēs visi sev esam uzdevuši jautājumu "Kam domāts galds? periodiski? ".
Ja vēlaties uzzināt kam paredzēta periodiskā tabula un kāpēc ir svarīgi saprast tā īpašības, turpiniet lasīt šo skolotāja mācību.
Indekss
- Periodiskās tabulas klasifikācija
- Elementa nosaukuma vai simbola atrašana ar periodisko tabulu
- Zināt elementa atomu masu
- Zināt elementa atomu skaitu
- Paredzēt elementa atomu rādiusu
- Salīdziniet divu elementu jonizācijas enerģiju
- Ķīmiskā elementa elektronegativitātes atrašana
- Salīdziniet divu elementu elektronu afinitāti
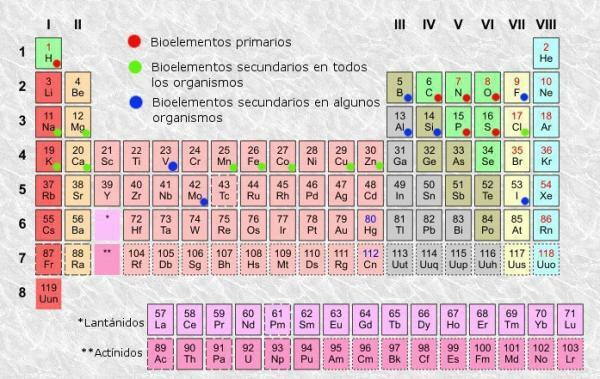
Periodiskās tabulas klasifikācija.
Tāpat kā jebkurā tabulā, arī
periodiskā tabula no elementiem mēs varam atšķirt kolonnas (vertikāli) un rindas (horizontāli). Periodiskajā tabulā ir 18 kolonnas vai grupas un 7 rindas vai punkti.Turklāt jūs varēsiet pārbaudīt, vai katrā tabulas lodziņā parasti parādās vismaz šāda informācija:
- Ķīmiska elementa simbols: saīsinājumi vai zīmes, ko izmanto elementu identificēšanai. Parasti tie sastāv no viena vai diviem burtiem, no kuriem pirmais vienmēr tiek ievadīts ar lielo burtu.
- Ķīmiska elementa nosaukums: ķīmiskā elementa nosaukums, kas atbilst augšējam saīsinājumam. Parasti tas atrodas zem simbola.
- Atomu numurs: kopējais protonu skaits, kas ir katram šī elementa atomam. Parasti tas tiek parādīts vienuma lodziņa augšējā kreisajā stūrī (vai pilnīgāku tabulu augšējā labajā stūrī).
- Atomu masa: atoma masu parasti var uzskatīt par protonu un neitronu kopējo masu vienā atomā. Tas ir pieejams zem elementa nosaukuma vienkāršākajās tabulās, lai gan citās tas var parādīties elementa lodziņa labajā augšējā daļā.
Ir periodiskas tabulas, kurās ir iekļauta cita sarežģītāka un specifiskāka informācija, piemēram, oksidēšanās stāvokļi (noderīgi, piemēram, formulējot ķīmiskos savienojumus), jonizācijas enerģija, elektronegativitāte utt., bet periodiskās pamatgaldi parasti sniedziet pietiekami daudz informācijas un parasti pietiek vidusmēra lietotājam, kurš no tā var uzzināt tādu informāciju, kādu mēs jums pastāstām tālāk.

Uzziniet elementa nosaukumu vai simbolu ar periodisko tabulu.
Dažreiz mēs zinām ķīmiskā elementa simbols bet mēs nezinām viņa vārdu. Citreiz mēs zinām ķīmiskā elementa nosaukums, bet ne tā saīsinājumu vai simbolu. Patiesībā ir ļoti viegli, ka tas kādreiz notika ar jums klasē.
Šādos gadījumos mēs varam izmantot periodisko tabulu, neprasot, lai tā būtu sarežģīta, un ātri un precīzi izpētītu trūkstošos datus.
Zināt elementa atomu masu.
Dažreiz mēs zinām ķīmisko elementu, ar kuru mums ir darīšana, bet mums tas jāzina atomu masa, tas ir, cik daudz šī elementa atoms sver.
Šī informācija būs noderīga, piemēram, veicot šādus uzdevumus:
- Aprēķiniet konkrēto vielas daudzumu.
- Analizējiet testos vai eksperimentos iegūtos rezultātus.
- Aprēķiniet masas procentuālo daudzumu.
- Izprotiet sarežģīto molekulu precīzās molārās masas.
Zināt elementa atomu skaitu.
Atomu skaitlis ir kopējais protonu skaits, kas ir elementa atomam. Elektriski neitrālā atomā, kas nav katjons (pozitīvi uzlādēts, ar vienu elektronu mazāk nekā normālā stāvoklī) vai anjonu (negatīvi lādēts, ar vienu elektronu vairāk nekā parastajā stāvoklī), protonu skaits ir vienāds ar elektroni.
Protonu skaits ir izšķirošais faktors, lai atdalītu vienu elementu no cita, jo elektronu vai neitronu skaits nemaina elementa tipu.

Paredzēt elementa atomu rādiusu.
Atomu rādiuss ir puse no attāluma starp viena un tā paša elementa divu atomu centru, kas tikko pieskaras viens otram. Šajā gadījumā zināt ķīmiskā elementa atrašanās vieta periodiskajā tabulā Tas var mums palīdzēt noskaidrot tā aptuveno atomu rādiusu vai salīdzināt to ar citu elementu. Lai to izdarītu, mums tas ir jāzina atoma rādiuss:
- Tas palielinās, pārejot no periodiskās tabulas augšas uz apakšu.
- Tas pazeminās, kad mēs pārvietojamies no kreisās uz labo pa periodisko tabulu.
Tādā veidā kalcijs ir mazāks par rubīdiju, bet lielāks par dzelzi.
Uzziniet vairāk par Kāds ir atoma rādiuss ar šo citu video stundu no SKOLOTĀJA.
Salīdziniet divu elementu jonizācijas enerģiju.
The jonizācijas enerģija ir enerģija, kas nepieciešama, lai noņemtu elektronu no elementa atoma. Šajā gadījumā, ja mēs zinām divu elementu stāvokli periodiskajā tabulā, mēs varam zināt, kuru elementu būs vieglāk "noņemt" elektronu. Mums būs jāņem vērā tikai tas, ka:
- Jonizācijas enerģija samazinās, pārvietojoties periodiskās tabulas augšup un lejup.
- Jonizācijas enerģija palielinās, pārejot no periodiskās tabulas pa kreisi uz labo pusi.
Starp beriliju un skābekli skābeklim ir lielāka jonizācijas enerģija. Ja salīdzinām skābekli un sēru, kas ir vienā grupā, bet nākamajā periodā, skābeklim ir arī augstāka jonizācijas enerģija, jo tā ir augstāka periodiskajā tabulā.
Atrodiet ķīmiskā elementa elektronegativitāti.
Elektronegativitāte ir atoma spēja piesaistīt elektronus. Praksē tas nozīmē spēju veidot ķīmisko saiti. Lai uzzinātu, vai ķīmiskajam elementam būs liela spēja veidot ķīmisko saiti vai nē, mums jāņem vērā tikai periodiskajā tabulā parādītais modelis, tas ir:
- Tas nokāpj, pārvietojoties augšup un lejup.
- Tas palielinās, pārvietojoties no kreisās uz labo pusi.
Tāpat kā iepriekšējā gadījumā, skābeklis ir vairāk elektronegatīvs nekā berilijs un sērs, jo tas atrodas tālāk pa labi nekā pirmais un augstāks par sēru.

Salīdziniet divu elementu elektronu afinitāti.
The Elektroniskā līdzība vai viņš ir enerģijas izmaiņas, kuras notiek neitrālā atoma laikā, kad tas piesaista elektronu kļūt par negatīvu jonu. Šajā gadījumā elektroniskā afinitāte nemainās tikpat precīzi kā iepriekšējos gadījumos, lai gan mēs varam teikt, ka kopumā elektroniskā afinitāte:
- Tajā pašā periodā tas paceļas no kreisās uz labo pusi.
- Pacelieties tajā pašā grupā no apakšas uz augšu.
Ja vēlaties lasīt vairāk līdzīgus rakstus Kam paredzēta periodiskā tabula?, iesakām ievadīt mūsu kategoriju Atoms.
Atsauces
Vai jums ir kāds ievads vai komentārs par periodiskās tabulas lietojumu? Jūtieties brīvi atstāt to mūsu komentāru sadaļā! Vai jums patika šis raksts? Jūs varat arī atstāt savu vērtējumu zemāk!