Atoma struktūra un raksturojums

Attēls: SlidePlayer
Atomi ir daļa no mūsu pasaules. Visas matērijas ir veidotas no atomiem, tāpēc ir svarīgi labāk saprast, no kā tie sastāv un kādas ir to funkcijas. Šajā skolotāja stundā mēs jums pastāstīsim, kas ir atoma uzbūve un raksturojums. Ja vēlaties uzzināt vairāk par daļiņām, kas veido visu vielu, turpiniet lasīt šo rakstu.
Indekss
- Kas ir atomi?
- Atoma struktūra
- Galvenās atoma īpašības
- Kas ir izotopi?
- Kā atomi atrodas dabā?
Kas ir atomi?
The atoms tas ir mazākā vienība, kurā var sadalīt matēriju nezaudējot ķīmiskās īpašības, tas ir, ķīmiskā elementa īpašības. Atoms ir visa, ko var redzēt vai pieskarties, izcelsme, sākot no zvaigznēm līdz jūsu rīta brokastīm.
Ja mēs noliekam malā tā ķīmisko īpašību zudumu, mēs varam teikt, ka atoms sastāv no dažādām daļiņām, ko sauc par subatomiskām daļiņām. Ir trīs veidu subatomiskās daļiņas -protoni, neitroni un elektroni- ar dažādām īpašībām.
Šīs daļiņas tiek sagrupētas dažādos skaitļos, veidojot ķīmiskos elementus (skābekli, oglekli utt.), Taču tās vienmēr tiks sadalītas pēc fiksētas struktūras.

Attēls: Google vietnes
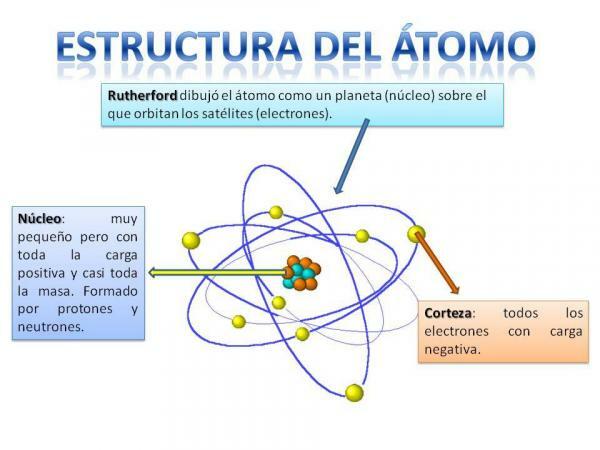
Atoma struktūra.
Atoma struktūra ir fiksēta, tas ir, mums var būt dažāda veida atomi (ūdeņraža atoms, skābekļa atoms utt.), taču to subatomiskās daļiņas vienmēr ir organizētas līdzīgi kā planētu sistēmā.
Jūs noteikti atcerēsities, kā Saules sistēma ir sakārtota: Saule atrodas centrā un apkārt no tā planētas rotē, aprakstot dažādas orbītas, dažas tuvāk un citas attālāk Sv. Atomu gadījumā centrā ir kodols, kuras forma ir līdzīga upenei un sastāv no neitroni un protoni.
Ap kodolu ir Garoza kura ir teritorija, caur kuru elektroni. Iepriekš tika uzskatīts, ka elektroni aprakstīja noteiktas orbītas, līdzīgi kā to dara planētas, lai gan tagad tā ir zina, ka šīs orbītas nav tik precīzi noteiktas un drīzāk ir līdzīgas jomām, kurās mēs, visticamāk, atrodamies elektroni.
Attēls: REA - Plāns Ceibal
Galvenās atoma īpašības.
Turpinot šo nodarbību par atoma struktūru un īpašībām, ir svarīgi koncentrēties uz elementiem, kas atomu uzskata par tādu.
Un tam mums jāatbild uz šo jautājumu: Kāpēc visi atomi nolemj pasūtīt sevi tādā noteiktā veidā? Atbilde ir vienkārša: tas ir saistīts ar elektriski pievilcīgi spēki. Atoma kodolu veido neitroni, kuriem nav elektriskā lādiņa, un protoni, kuriem ir pozitīvs elektriskais lādiņš. un elektroniem ir negatīvs elektriskais lādiņš, tāpēc starp kodolu un elektroniem ir līdzīgs pievilcīgs spēks ražots starp diviem magnēta poliem, bet nav pietiekami spēcīgs, lai elektroni "nokristu" pie kodols.
Tas ir labāk saprotams, ja ņemam vērā kodola lielums: ja atomam būtu, piemēram, futbola stadiona dimensija, kodola centrā būtu bumbas izmērs no laukuma Cik liela pievilcība būtu jāpievērš futbola bumbai, lai uz tās nokristu stadiona balinātāji!
Neitronu funkcija
Tagad jums var rasties jautājums, un kādu lomu spēlē neitroni? Neskatoties uz to, ka tiem nav elektriskā lādiņa, neitroniem ir liela loma atomā: tie veido 99% no masas. Ja tas palīdz atcerēties, mēs varam teikt, ka atoms ir kā trīs draugu banda: smagais neitronu, pozitīvo protonu un negatīvo elektronu, kas iet ap neutronu un elektrons.
Elektronu kustība
Šajā brīdī es vēlos, lai mēs atgrieztos pie kaut kā, ko bijām atstājuši tintes glabāšanā: pie orbītām, kuras elektroni apraksta ap kodolu. Mēs to bijām teikuši elektroni griežas ap kodolu kā planētas dara ap Sauli, daži tuvāk nekā citi, kāpēc viņi to dara? Elektroni rotē vienā vai otrā apvalkā atbilstoši enerģijai, kas viņiem jāpārvieto prom no kodola, tas ir, tiem elektroniem, kas atrodas tuvāk kodolam, nav pietiekams spēks, lai pārvietotos prom no kodola, kamēr garozas attālākajos apvalkos (orbitālēs) esošajiem ir vairāk enerģijas un viņi ir spējuši attālināties no kodola. kodols. Turklāt katrā no orbitālēm maksimālā jauda ir 8 elektroni (okteta likums).
Atoma daļiņas
Mēs atgriezīsimies pie citas pieejas, kuru mēs esam darījuši iepriekš, bet neesam paskaidrojuši: atomus veido neitroni, protoni un elektroni, kas vienmēr apvienojas pēc vienas un tās pašas kodola un garozas struktūras, taču to dara dažādos skaitļos, veidojot dažādus ķīmiskos elementus. Kā mēs varam iegūt tik daudz elementu, kas apvieno tikai 3 daļiņu veidus? Ķīmiskajiem elementiem, kurus jūs kādreiz esat redzējuši attēloti periodiskajā tabulā, ir raksturīgs noteikts atomu skaits.
The atomu skaitlis (Z) Tas mums norāda protonu skaitu šāda veida atomu kodolā, kas ir vienāds ar elektronu skaitu normālos apstākļos. Tā, piemēram, visi atomi, kuriem ir 6 protoni (Z = 6), būs oglekļa atomi, un tiem būs vienādas ķīmiskās īpašības; atomi ar 5 protoniem (Z = 5) būs bora atomi, ar tādām pašām ķīmiskām īpašībām kā viens otram un atšķirīgi no oglekļa atomiem. Jums nav jājauc atomu skaitlis ar atomu svaru vai masas numurs (A), kas ir neitronu un protonu svara summa (elektronu svars ir nenozīmīgs attiecībā pret kopējā kodola svaru).

Attēls: SlidePlayer
Kas ir izotopi?
Dabā mēs varam atrast dažādus elementu "apakštipus" izotopi. Esmu pārliecināts, ka kādā brīdī esat dzirdējis par oglekli 14 - oglekļa radioaktīvo izotopu, ko izmanto, lai cita starpā noteiktu fosiliju vecumu. Izotopi ir divi atomi ar vienādu protonu skaitu (vienāds atomu skaitlis), bet atšķirīgs neitronu skaits (atšķirīga atomu masa). Tā paša elementa izotopus parasti sauc ar elementa nosaukumu, kam seko tā atomu masa.
Mūsu piemērā abi izotopi ir ogleklis, tāpēc to atomu skaits ir 6 (Z = 6), bet oglekļa 12 (“parastā” oglekļa) atoma svars ir 12 salīdzinājumā ar oglekļa 14 atomu svaru 14. Tā paša elementa izotopiem ir ļoti līdzīgas ķīmiskās un fizikālās īpašības. Oglekļa 14 gadījumā, atšķirībā no oglekļa 12, tas ir radioaktīvs izotops, kas atrodas visos elementos, kas satur oglekli, ieskaitot dzīvās būtnes.
Un ar to mēs beidzam šo stundu par atoma struktūru un īpašībām. Mēs ceram, ka tas jums ir bijis noderīgs.

Attēls: jūsu uzdevumi
Kā atomi atrodas dabā?
Atomus var atrast atsevišķi, bet visnormālākais ir tos atrast apvienoti grupās sauca molekulas.
Molekulas var veidot viena un tā paša elementa atomi (piemēram, skābekļa molekula, kas sastāv no diviem skābeklis) vai pa grupām ar dažādu elementu atomiem (divi ūdeņraža un viens skābekļa atomi veido Ūdens). Šīs elementu grupas sauc par molekulām, kuras savukārt var kombinēt savā starpā un veidojot dažādas arvien sarežģītākas grupas atbilstoši to reaktivitātei un ķīmiskajai afinitātei pret Avots ķīmiskās saites.
Ja vēlaties lasīt vairāk līdzīgus rakstus Atoma struktūra un raksturojums, iesakām ievadīt mūsu kategoriju Atoms.



