Waar is de PERIODIEKE TABEL voor?
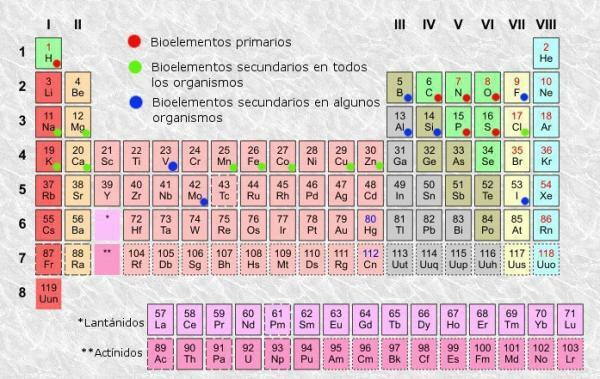
Het periodiek systeem is een classificatiesysteem voor atomaire elementen, uitgevonden in 1869 door de Russische chemicus Dmitri Mendelejev en later gereorganiseerd en bijgewerkt door andere scheikundigen totdat hij zijn verschijning bereikte actueel. Ondanks dat het een hulpmiddel is dat in de loop van de geschiedenis nuttig is gebleken (daarom wordt het nog steeds gebruikt en bijgewerkt), is het een zo vervelend om te leren en te begrijpen, daarom hebben we onszelf allemaal wel eens de vraag gesteld: "Waar is de tafel voor? periodiek?".
Als je het wilt weten waar is het periodiek systeem voor? en waarom het belangrijk is om de eigenschappen ervan te begrijpen, blijf deze les van een LERAAR lezen.
Inhoudsopgave
- Classificatie van het periodiek systeem
- De naam of het symbool van een element vinden met het periodiek systeem
- Ken de atoommassa van een element
- Ken het atoomnummer van een element
- Voorspel de atoomstraal van een element
- Vergelijk de ionisatie-energie van twee elementen
- De elektronegativiteit van een chemisch element vinden
- Vergelijk de elektronenaffiniteit van twee elementen
Classificatie van het periodiek systeem.
Zoals in elke tabel, in Het periodiek systeem van de elementen kunnen we kolommen (verticaal) en rijen (horizontaal) onderscheiden. In het periodiek systeem zijn er 18 kolommen of groepen en 7 rijen of perioden.
Bovendien hebt u kunnen verifiëren dat normaal gesproken in elk van de vakken van de tabel ten minste de volgende informatie wordt weergegeven:
- Symbool scheikundig element: afkortingen of tekens die worden gebruikt om de elementen te identificeren. Ze bestaan meestal uit een of twee letters, waarvan de eerste altijd met een hoofdletter wordt geschreven.
- Naam van chemisch element: naam van het chemische element dat overeenkomt met de bovenste afkorting. Het staat meestal onder het symbool.
- Atoom nummer: totaal aantal protonen dat elk atoom van dat element heeft. Het verschijnt meestal linksboven in het itemvak (of rechtsboven in meer complete tabellen).
- Atoom massa: massa van een atoom kan normaal gesproken worden beschouwd als de totale massa van protonen en neutronen in een enkel atoom. Het is gerangschikt onder de elementnaam in de eenvoudigste tabellen, hoewel het in andere kan verschijnen in de rechterbovenhoek van het elementvak.
Er zijn periodieke tabellen die andere soorten meer complexe en specifieke informatie bevatten, zoals: oxidatietoestanden (handig bij het formuleren van bijvoorbeeld chemische verbindingen), ionisatie-energie, elektronegativiteit, enz. geven voldoende informatie en zijn meestal voldoende voor de gemiddelde gebruiker, die er informatie uit kan halen zoals we u hieronder vertellen.

Ontdek de naam of het symbool van een element met het periodiek systeem.
Soms kennen we de symbool van scheikundig element maar we weten zijn naam niet. Op andere momenten kennen we de naam scheikundig element, maar niet de afkorting of het symbool. In feite is het heel gemakkelijk dat dit je ooit is overkomen in de klas.
In deze gevallen kunnen we terugvallen op een periodiek systeem, zonder dat het ingewikkeld hoeft te zijn, en de ontbrekende gegevens snel en accuraat raadplegen.
Ken de atoommassa van een element.
Soms kennen we het chemische element waarmee we te maken hebben, maar we moeten het weten atoom massa, dat wil zeggen, hoeveel een atoom van dat element weegt.
Deze informatie is bijvoorbeeld nuttig bij het uitvoeren van de volgende taken:
- Bereken de specifieke hoeveelheid van een stof.
- Analyseer de resultaten die zijn verkregen in de tests of experimenten.
- Bereken het percentage van de massa.
- Begrijp de precieze molmassa's van complexe moleculen.
Ken het atoomnummer van een element.
Het atoomnummer is totaal aantal protonen dat een atoom van een element heeft. In een elektrisch neutraal atoom, anders dan een kation (positief geladen, met één elektron minder dan zijn normale toestand) of een anion (negatief geladen, met één elektron meer dan zijn normale toestand), het aantal protonen is gelijk aan dat van elektronen.
Het aantal protonen is de beslissende factor als het gaat om het onderscheiden van het ene element van het andere, aangezien het aantal elektronen of neutronen het type element niet verandert.

Voorspel de atoomstraal van een element.
De atoomstraal is de helft van de afstand tussen het centrum van twee atomen van hetzelfde element die elkaar nauwelijks raken. Ken in dit geval de positie van een chemisch element in het periodiek systeem period Het kan ons helpen om de geschatte atomaire straal te achterhalen of te vergelijken met een ander element. Hiervoor moeten we weten dat de atomaire straal:
- Het neemt toe naarmate we van de bovenkant naar de onderkant van het periodiek systeem gaan.
- Het daalt als we van links naar rechts door het periodiek systeem gaan.
Op deze manier is calcium kleiner dan rubidium maar groter dan ijzer.
Leer meer over Wat is de atoomstraal met deze andere videoles van een LERAAR.
Vergelijk de ionisatie-energie van twee elementen.
De ionisatieenergie is de energie die nodig is om een elektron uit het atoom van een element te verwijderen. In dit geval, als we de positie van twee elementen in het periodiek systeem kennen, kunnen we weten van welk element het gemakkelijker is om een elektron te "nemen". We hoeven er alleen rekening mee te houden dat:
- Ionisatie-energie neemt af naarmate het op en neer beweegt in het periodiek systeem.
- Ionisatie-energie neemt toe naarmate je van links naar rechts van het periodiek systeem beweegt.
Tussen beryllium en zuurstof heeft zuurstof meer ionisatie-energie. Als we zuurstof en zwavel vergelijken, dat in dezelfde groep zit maar in de volgende periode, heeft zuurstof ook een hogere ionisatie-energie omdat het hoger in het periodiek systeem staat.
Ontdek de elektronegativiteit van een chemisch element.
Elektronegativiteit is de vermogen van een atoom om elektronen aan te trekken. In de praktijk vertaalt dit zich in het vermogen om een chemische binding te vormen. Om te weten of een chemisch element een groot vermogen heeft om een chemische binding te vormen of niet, hoeven we alleen rekening te houden met het patroon dat volgt in het periodiek systeem, namelijk:
- Het daalt terwijl het op en neer beweegt.
- Het neemt toe naarmate je van links naar rechts beweegt.
Net als in het vorige geval is zuurstof meer elektronegatief dan beryllium en zwavel, omdat het verder naar rechts is dan het eerste en hoger dan zwavel.

Vergelijk de elektronenaffiniteit van twee elementen.
De Elektronische affiniteit is hij verandering in energie die een neutraal atoom ondergaat wanneer het een elektron aantrekt om een negatief ion te worden. In dit geval varieert de elektronische affiniteit niet zo precies als in de vorige gevallen, hoewel we kunnen zeggen dat, in het algemeen, de elektronische affiniteit:
- Het stijgt, in dezelfde periode, van links naar rechts.
- Stijg op, in dezelfde groep, van onder naar boven.
Als u meer artikelen wilt lezen die vergelijkbaar zijn met Waar dient het periodiek systeem voor?, raden we u aan om onze categorie van het atoom.
Referenties
Heeft u een inbreng of opmerking over het gebruik van het periodiek systeem? Laat het gerust achter in onze commentaarsectie! Vond je dit artikel leuk? Je kunt hieronder ook je beoordeling achterlaten!



