Wat zijn CHEMISCHE FORMULES en waarvoor dienen ze [SAMENVATTING + VIDEO'S]
Al lijkt het niet, de chemische elementen van het periodiek systeem Ze omringen ons aan alle kanten. Vaak worden ze echter niet afzonderlijk gevonden, maar vormen ze moleculen of macromoleculen van verschillende chemische elementen. Chemische formules zijn de grafische uitdrukking van deze verbindingen en worden gebruikt om hun nomenclatuur te standaardiseren. In deze les van een LERAAR zullen we zien wat zijn chemische formules en waar zijn ze voor?. Doe mee om meer te weten te komen!
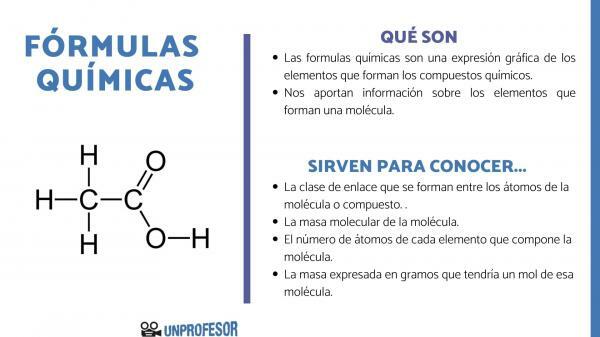
De chemische formules zijn een grafische uitdrukking van de elementen waaruit de chemische bestanddelen.
Deze chemische formules zijn niet willekeurig, maar volgen enkele: strikte regels van de chemische nomenclatuur, vastgesteld door de IUPAC (Internationale Unie van Pure en Toegepaste Chemie).
Chemische formules geven ons ook informatie over de elementen waaruit een molecuul bestaat, dus het vertelt ons bijvoorbeeld het aantal en de respectieve verhoudingen van elk van de atomen waaruit het bestaat en soms zelfs het type Chemische binding die tussen die elementen bestaat.
Elk molecuul of macromolecuul dat bestaat, komt overeen met zijn chemische formule, maar er zijn verschillende soorten formules. Elk van deze typen geeft ons verschillende informatie over het molecuul, maar ze helpen ons allemaal om de molecuul ervan te begrijpen Chemische aard en het helpt ons te begrijpen wat er gebeurt in chemische reacties en hoe de ene verbinding in andere kan veranderen.
Maar om deze chemische nomenclatuur te begrijpen, is het noodzakelijk om bepaalde kennis van scheikunde te hebben, omdat ze een vrij gespecialiseerde technische taal gehoorzamen.

Afbeelding: Slideplayer
De chemische formules worden vertegenwoordigd door de vereniging van chemische symbolen, met de corresponderende letter van elk atoom zoals het komt in de periodiek systeem, en subscripts, die getallen zijn die het aantal daarvan vertegenwoordigen atomen in het molecuul
Binnen de chemie (zowel organisch als anorganisch) zijn er bepaalde fragmenten of verbindingen die vertonen een zekere herhaling, zowel structureel als functioneel en worden geïdentificeerd door namen specifiek. Wanneer deze fragmenten vrije elektronen hebben die niet worden gedeeld, worden ze radicalen genoemd en zijn het onstabiele, zeer reactieve verbindingen met een korte halfwaardetijd.
Voorbeelden van radicalen zijn: methylgroepen CH3, nitraatgroepen NO3, hydroxylgroepen OH- of de rest Cl-. Ze staan echter bekend als functionele groepen wanneer het atomen of groepen atomen zijn die aan een keten zijn bevestigd kooldioxide (met verschillende koolstof) en die verantwoordelijk zijn voor de reactiviteit en chemische eigenschappen van moleculen.
Deze groepen zijn vooral belangrijk binnen de organische chemie (menselijke biomoleculen zijn in feite koolstof en waterstof). Enkele voorbeelden van functionele groepen zijn de carbonylgroep = C = O of de carboxylgroep -COOH.

Afbeelding: Monogramas.com
Zoals we zeiden, er zijn verschillende soorten chemische formules. Elk van deze formules geeft ons een ander type informatie over de moleculen en daarom het dient een bepaald doel, zonder dat een formule in het algemeen beter of slechter is dan een andere.
De klassen van chemische formules die we onderscheiden zijn:
Empirische formules
Empirische formules zijn de eenvoudigste formules om een chemisch molecuul weer te geven, soms zeggen ze dat het minimale formules zijn. Deze formules vertegenwoordigen het aandeel van de atomen van elk van de elementen in het molecuul, die zijn vereenvoudigd tot hele getallen, altijd de kleinste. Een voorbeeld van deze formule is CH3 (methylgroep), met drie waterstofatomen en één koolstofatoom.
Deze formules kunnen echter soms misvattingen geven over de samenstelling van het molecuul. Dit gebeurt wanneer de formule niet het werkelijke aantal atomen in het molecuul aangeeft, zoals bij peroxide waterstof, waarvan de empirische formule HO is, terwijl de formule H2O2 zou moeten zijn (twee atomen waterstof en twee van zuurstof). Dit gebeurt dus via een nomenclatuurconventie, aangezien beide subscripts gelijk zijn, zijn ze vereenvoudigd.
Sommige verbindingen kunnen echter alleen worden weergegeven met empirische formules, omdat ze zijn opgebouwd uit ionennetwerken. Dit komt bijvoorbeeld voor in keukenzout of natriumchloride, dat wordt weergegeven als NaCl, wat aangeeft dat er voor elk natrium een chloor is.
Moleculaire formules
Dit soort formules zijn vrij eenvoudig, ze drukken eenvoudig het type atomen en het aantal van elk in een covalent molecuul uit. Het zijn formules die de chemische elementen en het getal op een lineaire manier presenteren (in de vorm van een subscript. Een voorbeeld van dit type formule is wanneer glucose C6H12O6 wordt genoemd, wat die glucose uitdrukt Glucosemolecuul bestaat uit zes koolstofatomen, twaalf waterstofatomen en zes van zuurstof.
Moleculaire formules worden veel gebruikt, waarbij soms wordt beweerd dat het de echte formules van moleculen zijn. In veel gevallen vallen ze samen met de empirische formules, bijvoorbeeld in CO2.
Halfontwikkelde formules
Halfontwikkelde formules zijn een soort formules die vergelijkbaar zijn met molecuulformules, omdat ze ook de atomen uitdrukken waaruit het molecuul bestaat en hun aantal, maar ook informatie verstrekken over chemische bindingen (weergegeven door lijnen tussen atomen) en het type binding tussen de koolstofatomen die het vormen (als ze enkelvoudig, dubbel of triples). De halfontwikkelde formule is nuttig voor het identificeren van de radicalen waaruit het molecuul bestaat en zijn chemische structuur (de bindingen tussen de koolstof- en waterstofatomen zijn niet weergegeven).
In het geval van glucose is de halfontwikkelde formule CH2OH - CHOH - CHOH - CHOH -CHOH - CHO en zoals te zien is, zijn de atomen van koolstof, waterstof en zuurstof zijn hetzelfde als in de molecuulformule (respectievelijk zes, twaalf en zes) en alle enkelvoudige bindingen (glucose heeft alleen bindingen eenvoudig). Deze formule is dus een complexere formule dan de molecuulformule.
Halfontwikkelde formules worden soms gecondenseerd genoemd en zijn misschien wel de meest gebruikte klasse van formules. gebruikt, vooral in de organische chemie, hoewel ze ons niet in staat stellen om de echte geometrie van de moleculen te observeren.
Ontwikkelde formule
De ontwikkelde formules zijn wat complexer dan de semi-ontwikkelde. In dit type formules worden de binding en de locatie van elk atoom in het molecuul weergegeven in een Cartesiaans vlak, totdat de hele verbinding is weergegeven.
Structurele Formule
De structuurformule is een grafische weergave van de structuur van het molecuul in de ruimte en geeft ons informatie over de volgorde en verdeling van atomen in de ruimte. In deze formule worden ook de chemische bindingen waaruit het molecuul bestaat weergegeven en of ze enkel, dubbel of drievoudig zijn. Deze formule geeft ons daarom de meeste informatie over het molecuul.
Dit soort formules worden meer op professioneel niveau gebruikt in de wereld van de chemie, omdat ze het mogelijk maken om de chemische reacties of synthese van nieuwe moleculen veel duidelijker te zien.
Lewis formules
Dit zijn complexe, zeer specifieke en technische formules. Ze zijn ook bekend als Lewis-diagrammen of -structuren en lijken op de ontwikkelde formules van moleculen, maar Bovendien worden de elektronen aangegeven die de atomen in elke chemische binding delen, die variëren met de valentie van de atomen betrokken.
In deze formules worden de bindingen tussen atomen weergegeven door lijnen (die ook aangeven of ze enkel, dubbel of drievoudig zijn) of met een paar stippen. De solitaire elektronen of elektronen die niet in de binding worden gedeeld, worden weergegeven door punten rond het atoom waarmee het overeenkomt.

Afbeelding: Organische Chemie
Bij het schrijven van formules wordt soms verwezen naar deoxidatie nummer van het element (het komt vaak voor in ionische verbindingen). Dit zijn een reeks positieve en negatieve getallen die gaan geassocieerd met elk element.
- De oxidatiegetallen kunnen worden geïnterpreteerd als de aantal elektronen dat een element deelt in een covalente binding of overdraagt in een ionische binding.
- Wanneer het oxidatieteken boven het atoom is negatief, betekent dat dit element elektronen vangt en het getal dat ernaast staat is het aantal gevangen elektronen. Daarom betekent een oxidatietoestand van -1 dat het element één elektron oppikt, -2 dat er twee oppikt, enzovoort.
- Wanneer het teken van oxidatie is positief, het atoom geeft een elektron af en het getal dat bij dit teken hoort, is het aantal opgegeven elektronen. Evenzo betekent een oxidatietoestand van +1 dat het één elektron oplevert, +2 dat het er twee oplevert, enzovoort.
Dit werkt meestal voor Ionische bestanddelen, in covalente bindingen, hoewel de interpretatie vergelijkbaar is, is deze niet hetzelfde omdat deze bindingen elektronen delen. In deze verbindingen spreken we van meer elektronegatieve elementen, die meer van het elektronische paar trekken en een meer negatieve lading hebben, afhankelijk van het aantal elektronen dat het aantrekt. Dit is te zien in de Lewis formules.
Als je wilt weten waar chemische formules voor zijn, moet je er rekening mee houden dat dit aantal ons in staat stelt om wat te verkrijgen informatie over moleculen, zoals ze zijn:
- De link klasse die worden gevormd tussen de atomen van het molecuul of de verbinding. Deze bindingen zijn normaal gesproken covalent wanneer niet-metalen en ionische atomen eraan deelnemen als het metalen en niet-metalen bindingen zijn.
- De moleculaire massa van het molecuul.
- De aantal atomen van elk element waaruit het molecuul bestaat. Het wordt soms de centesimale samenstelling van het molecuul genoemd.
- De massa uitgedrukt in gram dat zou één mol van dat molecuul hebben.
In het geval van een ionische verbinding, bijvoorbeeld natriumchloride of keukenzout, is het niet strikt correct praten over moleculen (hoewel het soms wordt gedaan), dat deze de neiging hebben om grote aggregaten te vormen en macromoleculen. In dit geval helpt de formule van de verbinding ons om te zien welke ionen het vormen en in welke hoeveelheid.