Wat zijn de VALENTIES van STIKSTOF?

Stikstof is een zeer belangrijk chemisch element in ons leven, Zowel ten goede als ten kwade. Het is het belangrijkste gas in de atmosfeer, het is aanwezig in de bodem en het is een zeer belangrijk macromolecuul voor de meeste levende wezens. Het maakt ook deel uit van verbindingen van groot industrieel belang zoals ammoniak, drijfgassen of explosieven.
Wat er gebeurt, is dat de valentie en oxidatietoestand verschillen, afhankelijk van de verbinding. In deze les van een LERAAR zullen we het hebben over: wat zijn de valenties van stikstof?. Als je meer wilt weten over dit chemische element, zul je dit artikel leuk vinden!
Inhoudsopgave
- Wat is stikstof en eigenschappen?
- Wat zijn de valenties van stikstof?
- Nomenclatuur van stikstofverbindingen
- Belangrijke stikstofverbindingen
- Gezondheidseffecten van stikstof
- Milieueffecten van stikstof
Wat is stikstof en eigenschappen.
Stikstof is een scheikundig element met symbool N. met een atoomnummer van 7, een atoomgewicht van 14.0067 en onder normale omstandigheden in gasvormige toestand aangetroffen. Moleculaire stikstof vertegenwoordigt 78% van het volume in droge lucht en is daarom het belangrijkste gas dat in de atmosfeer aanwezig is.
Deze hoge stikstofconcentratie in de atmosfeer is het gevolg van elektrische actie in de atmosfeer, de fixatie van atmosferische stikstof door bacteriële werking, chemische werking in industrieën en het vrijkomen van stikstof door de afbraak van organisch materiaal of door de verbranding. In zijn gecombineerde toestandvormende verbindingen wordt stikstof in verschillende toestanden gevonden.
Het is een element van groot belang voor levende wezens, aangezien: Het maakt deel uit van alle eiwitten zowel plantaardig als dierlijk, en vele andere organische verbindingen. Stikstof vormt sterke bindingen met andere atomen zoals stikstof en andere, vanwege het vermogen om drievoudige bindingen vormenDaarom hebben stikstofverbindingen een grote hoeveelheid energie.
Stikstof bestaat uit twee isotopen:
- De N14 (zeer meerderheid)
- N15 en verschillende radioactieve isotopen, die ontstaan bij kernreacties.
Het is een element van groot belang in de chemische industrie en in verbindingen die in de landbouw worden gebruikt. Het wordt ook gebruikt in gloeilampen en wanneer een relatief inerte atmosfeer nodig is.
Stikstof in zijn elementaire vorm is bij normale temperaturen enigszins reactief met de meest voorkomende stoffen, terwijl bij verhoogde temperaturen reageert het met veel stoffen, zoals titanium, aluminium, silicium, boor, beryllium, calcium, lithium of chroom, met zuurstof (O2) reageert het vormen oxiden zoals lachgas (NO) en met waterstof bij hoge temperaturen en druk om een zeer belangrijke industriële verbinding te vormen zoals de ammoniak.
Afbeeldingsbron: Monographs.com
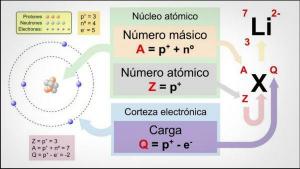
Wat zijn de valenties van stikstof?
De valenties van een chemisch element is hij nummer van elektronen wat ontbreken of wat moeten ze geven? om uw laatste elektronische niveau in te vullen.
De atomen ze hebben meestal 7 niveaus of lagen waar de elektronen zich bevinden, waarbij 1 de binnenste is en 7 de buitenste. Op hun beurt zijn er verschillende subniveaus, genaamd s, p, d en f. In een atoom vullen de elektronen de verschillende niveaus op basis van hun energieën, waarbij ze eerst de lagere energieniveaus vullen en dan naar een hoger niveau gaan.
Naar de buitenste niveau van het atoom het wordt ook wel genoemd valentie shell en de elektronen die zich in deze schil bevinden heten valentie-elektronen. Deze elektronen zijn verantwoordelijk voor de vorming van bindingen en de mogelijke chemische reacties. met andere atomen, dat wil zeggen, zij zijn de elektronen die verantwoordelijk zijn voor de fysische en chemische eigenschappen van a element.
De verschillende manieren waarop stikstof wordt gecombineerd, geven het een valentie (ook bekend als de oxidatietoestand). Stikstof is niet in staat om zijn valentieschil uit te breiden zoals andere elementen in zijn groep doen. De mogelijke valenties zijn -3, +3 en +5. De valentietoestand van stikstof varieert afhankelijk van de verbinding waarvan het deel uitmaakt. De andere elementen van de stikstoffamilie hebben ook deze oxidatietoestanden en zijn fosfor (P), antimoon (Sb), bismut (Bi), moscovium (Mc) en arseen (As).
De vorming van chemische verbindingen met stikstof kan worden verklaard volgens de valentiebindingstheorie, volgens de elektronische configuratie van elke oxidatietoestand van stikstof. Om het uit te leggen, wordt rekening gehouden met het aantal elektronen in zijn valentieschil en hoeveel er ontbreken om de elektronische configuratie van een edelgas te bereiken.

Nomenclatuur van stikstofverbindingen.
Stikstofverbindingen zijn chemisch complex en de traditionele nomenclatuur was niet genoeg om ze gemakkelijk te benoemen en te identificeren, dus die de International Union of Pure and Applied Chemistry (IUPAC) heeft opgericht (ook vanwege andere factoren) een systematische nomenclatuur waarin verbindingen worden genoemd naar het aantal atomen waaruit ze bestaan.
Deze nomenclatuur is vooral geschikt voor het benoemen van stikstofoxiden. Zo wordt stikstofmonoxide stikstofmonoxide en lachgas (NO), distikstofmonoxide (N2O) genoemd.
Naast deze nomenclatuur heeft de Duitse chemicus in 1919 Alfred Stock ontwikkelde een methode waarin verbindingen werden genoemd afhankelijk van de oxidatietoestand, weergegeven in Romeinse cijfers en tussen haakjes. Op deze manier zou stikstofoxide stikstofoxide (II) en lachgas, stikstofoxide (I) worden genoemd.

Afbeelding: Youtube
Belangrijke stikstofverbindingen.
Stikstof kan zich aan verschillende elementen binden en een groot aantal verbindingen vormen vanwege het grote aantal mogelijke oxidatietoestanden. In het geval van moleculaire stikstof is de valentie ervan per definitie 0.
Een van de meest voorkomende oxidatietoestanden is -3. In deze oxidatietoestand vormt stikstof verbindingen zoals ammoniak (NH3), het ammoniumion (NH4-), nitrillen (C≡N), iminen (C=N-R) of aminen (R3N). Wanneer stikstof zich in de oxidatietoestand -2 bevindt, zijn er nog 7 elektronen in de valentieschil. Het oneven aantal elektronen in zijn valentieschil maakt het gemakkelijk om overbruggingsbindingen te vormen tussen twee stikstofatomen. In deze toestand vormt stikstof hydrazonen (C=N-N-R2) en hedrazinen (R2-N-N-R2). In de -1 oxidatietoestand blijven 6 elektronen in de valentieschil en worden verbindingen zoals hydroxylamine (R2NOH) en azoverbindingen (RN=NR) gevormd.
Wanneer stikstof positieve oxidatietoestanden bereikt, Stikstof bindt zich aan zuurstofatomen om oxiden, oxyzuren of oxyzouten te vormen. In de +1 oxidatietoestand blijft stikstof achter met 4 elektronen in zijn valentieschil. Zo hebben we voorbeelden zoals distikstofoxide (N2O), in de volksmond bekend als lachgas, en lachgas (R=NO). In de +2-toestand hebben we stikstofoxide of stikstofoxide (NO), een kleurloos gas dat wordt gegenereerd tijdens de reactie van metalen met verdund salpeterzuur. Deze verbinding heeft een zeer onstabiele vrije radicaal die kan reageren met zuurstof om een belangrijke luchtverontreinigende stof te vormen, zoals stikstofdioxide (NO2)
In de +3-toestand worden verbindingen zoals nitriet gevormd in basische oplossing (NO2-) of salpeterigzuur in zure oplossing (HNO2). Beide zijn oxidatiemiddelen die aanleiding kunnen geven tot stikstofmonoxide (NO) of reductiemiddelen zijn om het nitraation te vormen. Andere verbindingen zijn distikstoftrioxide (N2O3) en de nitrogroep (R-NO2). In de +4-toestand hebben we stikstofdioxide (NO2) of stikstofdioxide. Dit is een bruin gekleurd gas dat wordt geproduceerd door de reactie van veel metalen met geconcentreerd salpeterzuur om distikstoftetroxide (N2O4) te vormen. Bij +5 kunnen we nitraten of salpeterzuur vinden, die oxidatiemiddelen zijn in zure oplossingen.
Eindelijk, Er zijn verbindingen waarin stikstof zich in verschillende oxidatietoestanden bevindt.. Dit zijn verbindingen zoals nitrosilazide of distikstoftrioxide.

Afbeelding: Ambientum
Effecten van stikstof op de gezondheid.
Moleculaire stikstof is de belangrijkste gasvormige component van atmosferisch gas. In water en bodem kunnen we het vinden in de vorm van nitraat en nitriet. Al deze verbindingen staan met elkaar in verbinding in de stikstofkringloop.
Door menselijk handelen zijn de concentraties nitraat en nitriet veranderd op het land, voornamelijk door het op de bodem uitbrengen van mest met nitraten. Bovendien wordt de concentratie van nitraten en nitrieten in bodem en water verhoogd door de stikstof die door de industrie wordt uitgestoten via de stikstofkringloop. Dit kan ook leiden tot een toename van stikstof in het drinkwater.
De effecten van nitraten en nitrieten op de menselijke gezondheid ze zouden kunnen zijn:
- Nitraten hebben een negatief effect op de activiteit van de schildklier
- Nitraten verminderen de opslag van vitamine A
- Zowel nitraten als nitrieten produceren nitrosaminen, wat een veelvoorkomende oorzaak van kanker is
- Nitriet reageert met hemoglobine, waardoor het zuurstoftransporterend vermogen van het bloed afneemt.
- Stikstofoxide (NO) is een fundamentele boodschapper in het menselijk lichaam en zorgt voor ontspanning spier, voordelen in het cardiovasculaire systeem of het uitoefenen van signaaleffecten op cellen van de immuunsysteem. Deze effecten worden al benut in meerdere medicinale toepassingen, zoals medicatie tegen hartaanvallen of Viagra.
Milieueffecten van stikstof.
De toevoeging van nitraten en nitrieten aan meststoffen veroorzaakt een verhoging van hun milieuconcentraties, evenals verschillende industriële processen. Veel van deze verbindingen kunnen ontsnappen naar de atmosfeer en reageren met zuurstof, waardoor luchtverontreinigende stoffen ontstaan die de toename van het broeikaseffect bevorderen.
Nitraten en nitrieten hebben op hun beurt ook nadelige effecten in zoet water en in het mariene milieu, een negatief effect hebben op dit ecosysteem en de soort die het bewonen. Ook nemen de concentraties van deze stikstofverbindingen in drinkwater drastisch toe, waardoor hun negatieve effecten op de menselijke gezondheid worden uitgeoefend.
Als u meer artikelen wilt lezen die vergelijkbaar zijn met Wat zijn de valenties van stikstof?, raden we u aan om onze categorie in te voeren van: het atoom.
Bibliografie
- Mayz Figueroa, J. (2004). Biologische stikstofbinding. UDO Landbouwwetenschappelijk tijdschrift, 4(1), 1-20.
- Celaya-Michel, H., & Castellanos-Villegas, A. EN. (2011). Stikstofmineralisatie in de bodem van aride en semi-aride zones. Terra Latinoamericana, 29 (3), 343-356.
- Cárdenas-Navarro, R., Sánchez-Yáñez, J. M., Farías-Rodriguez, R., & Peña-Cabriales, J. J. (2004). Stikstofinput in de landbouw. Chapingo Magazine Tuinbouw Serie, 10(2), 173-178.