Ewolucja TABELI OKRESOWEJ: od powstania do dnia dzisiejszego
Układ okresowy pierwiastków jest jednym z najbardziej kultowe ikony nauki. Choć rok 2019 minął 150. rocznicą jego powstania, nie jest to bynajmniej dokument skończony. W tej lekcji od NAUCZYCIELA zobaczymy, co ewolucja układu okresowego od jego powstania do dnia dzisiejszego i postępy w wiedzy o atomach i ich właściwościach umożliwiły to.
Indeks
- Czym jest układ okresowy pierwiastków?
- Pierwszy układ okresowy: pochodzenie
- Historia układu okresowego i ewolucji
Czym jest układ okresowy pierwiastków?
układ okresowy pierwiastków Układ okresowy pierwiastków jest dokumentem naukowym, który skupia więcej informacji na mniejszej przestrzeni i stanowi jedną z najpotężniejszych ikon nauki. Zawiera dużą część wiedza jaką posiadamy na temat chemii. Nie ma podobnego dokumentu w żadnej innej dyscyplinie naukowej.
Układ okresowy pierwiastków to a system klasyfikacji pierwiastków chemicznych Zaczęło się ponad 200 lat temu. Ten system klasyfikacji rozwijał się i zmieniał z biegiem czasu, w miarę postępu nauki i odkrywania nowych.
pierwiastki chemiczne. Jednak różne modyfikacje zostały wprowadzone, zachowując jego podstawową strukturę nienaruszoną.Układ okresowy jest tak nazwany, ponieważ wyraża graficznie sposób, w jaki powtarzają się w regularnych odstępach czasu, pewny właściwości chemiczne. Jest to rodzaj reprezentacji dwuwymiarowej lub, w jej bardziej nowoczesnych przedstawieniach, trójwymiarowej.
w klasyczny układ okresowy (dwuwymiarowy) pierwiastki chemiczne są ułożone w grupy lub rodziny i są reprezentowane w bieżącym układzie okresowym w pionowych kolumnach. Uporządkowane rozmieszczenie tych grup w kolumnach daje początek serii wierszy, które nazywane są okresami, w których elementy są uporządkowane zgodnie z ich wagą atomową. Układ okresowy składa się z siedmiu okresów o różnej długości.

Pierwszy układ okresowy: pochodzenie.
Przed Mendelejewem inni naukowcy opracowali systemy klasyfikacji pierwiastków chemicznych. Ale w przeciwieństwie do układu okresowego pierwiastków, były one zwykłe listy znanych elementów; natomiast układ okresowy charakteryzuje się tym, że jest systemem klasyfikacji w dwóch wymiarach (wierszerow i kolumny) lub w trzech wymiarach, w swoich najnowocześniejszych wersjach, gdzie pierwiastki ułożone są kolejno in warstwy.
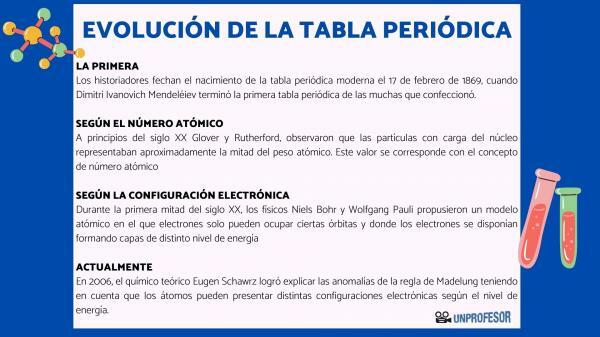
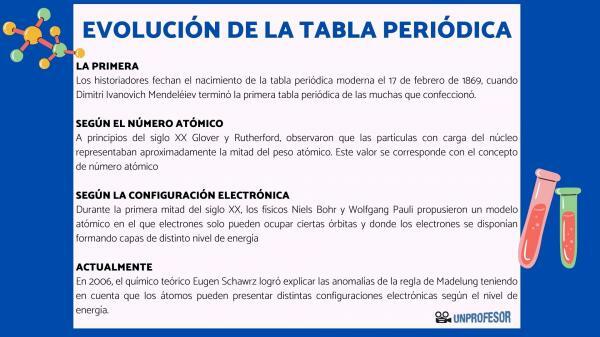
Z tego powodu historycy datują narodziny współczesnego układu okresowego pierwiastków 17 lutego 1869 roku, gdy Dymitr Iwanowicz Mendelejew Zakończ pierwszy układ okresowy z wielu, które stworzył. Ta tabela składała się z 63 elementów ułożonych w rodziny i pozostawiała puste miejsca na elementy jeszcze nie odkrył, ale z którego wydedukował ich masę atomową (jak w przypadku galu, germanu i Skand)
Kluczowymi danymi do odkrycia układu okresowego była wcześniejsza znajomość masa atomowa każdego elementu.
Co to jest masa atomowa i liczba atomowa?
Ten numer reprezentował wagę atomu i była to jedyna mierzalna wartość atomy. Ale w żadnym wypadku nie chodziło o pomiary bezpośrednie (nie ma urządzeń pomiarowych pozwalających na ważenie izolowanych atomów), ale raczej był to system, który ustanowił wzorzec, w którym atomowi wodoru nadano arbitralną wartość 1 i względem tego obliczono wartość masy atomowej pozostałych pierwiastków Wzór.
Pierwsze obliczenia Liczba atomowa pierwiastków wykonał angielski chemik John Daltoni wywołał wielką debatę naukową w pierwszej połowie XIX wieku. Jednak w drugiej połowie XIX wieku istniał już niezwykły konsensus co do systemu obliczania mas atomowych pierwiastków. Od Mendelejewa ciężar atomowy stał się kluczowym kryterium prawidłowego uporządkowania pierwiastków w układzie okresowym pierwiastków.
Kiedy Mendelejew uporządkował znane elementy według ich zwiększenie masy atomowej, zaobserwował pojawianie się powtarzających się właściwości, które umożliwiały grupowanie elementów w grupy lub rodziny elementów, które były do siebie podobne. Jednak w niektórych przypadkach kolejność pierwiastków według ich masy atomowej nie odpowiadała podobieństwom między zaobserwowanymi pierwiastkami, a Mendelejew zmienił się położenie 17 pierwiastków w układzie układu okresowego pomimo ich mas atomowych, aby móc je pogrupować z tymi pierwiastkami, z którymi przedstawili analogie.
Zmiany te pokazały, że niektóre z przyjętych mas atomowych nie były poprawne i zostały ponownie obliczone. Pomimo poprawek w masach atomowych nadal istniały elementy, które musiały być umieszczone w pozycjach innych niż te, które wskazują ich masy atomowe.

Zdjęcie: BBC.com
Historia układu okresowego i ewolucji.
Mimo niewątpliwego wkładu Mendelejewa układ okresowy pierwiastków nie jest wynikiem pracy jednego badacza. Oprócz Mendelejewa w drugiej połowie XIX wieku i przez cały wiek XX wielu Chemicy nadal badali najlepszy sposób organizowania informacji o pierwiastkach chemicznych znany. Tym bardziej, że w tym czasie odkrycie nowe pierwiastki chemiczne lub proste substancje, dzięki spektrometrii (która bada interakcje między atomami i promieniowaniem elektromagnetycznym).
klasyfikacja elementów w układzie okresowym była początkowo oparta na początkowych obliczeniach masy atomowe elementów i ujawnione analogie, które pozwoliły na pogrupowanie elementów w analogiczne rodziny. Mimo to nie można było wyjaśnić przyczyny pojawienia się tych okresowych właściwości. Dopiero w XX wieku, wraz z odkryciem struktury elektronowej, zrozumiano przyczynę tej okresowości we właściwościach pierwiastków.
Liczba atomowa jako porządek sortowania
Na początku XX wieku Glover i Rutherford, zaobserwowali, że naładowane cząstki w jądrze stanowią około połowy masy atomowej. Ta wartość odpowiada koncepcji Liczba atomowa który jest zdefiniowany jako liczba protonów w jądrze atomowym i który pokrywa się z liczbą elektronów w obojętnym atomie. Ta nowa wartość uzasadniała dotychczasowe zmiany położenia niektórych elementów. Na przykład zmiana pozycji między tellurem a jodem.
W 1913 roku Henryk Moseley potwierdził uporządkowanie tabeli w funkcji liczby atomowej za pomocą spektrometrii rentgenowskiej. Porządek według liczby atomowej obowiązuje do dziś.
W tym samym czasie w XX wieku wciąż odkrywano nowe pierwiastki chemiczne dzięki mechanice kwantowej i rozwojowi techniki bombardowanie atomów cząsteczkami, z drugiej połowy wieku. Dzięki tej nowej technice możliwe było stworzenie sztuczne elementy które nie występują w naturze.
Chociaż poczyniono postępy we właściwym rozmieszczeniu pierwiastków w układzie okresowym, nadal powód powtarzającego się występowania pewnych właściwości (właściwości) okresowy). Rozwój mechanika kwantowa (gałąź fizyki zajmująca się badaniem zachowania światła i atomów w skali mikroskopowej) z 1920 roku była decydująca dla wyjaśnienia przyczyny tych właściwości.
Konfiguracja elektroniczna jako wyjaśnienie właściwości okresowych
W pierwszej połowie XX wieku fizycy Niels Bohr Tak Wolfgang Pauli zaproponowali model atomowy, w którym elektrony mogą zajmować tylko określone orbity i gdzie elektrony są ułożone tworząc warstwy o różnych poziomach energii. Sposób, w jaki elektrony są rozmieszczone na orbitalach w różnych powłokach lub poziomach energii, jest znany jako elektroniczna Konfiguracja.
Odkrycie układu elektronów w konfiguracjach elektronowych miało fundamentalne znaczenie dla zrozumienia okresowości właściwości. okresowo, gdyż zaobserwowano, że właściwości te są ściśle związane z najbardziej zewnętrzną konfiguracją elektronową atomów (warstwa Walencja).
Kolejność, w jakiej elektrony wypełniają orbitale atomowe, została ustalona w 1930 roku przez fizyka Erwina Madelunga, który ustanowił liczbową regułę kolejności wypełniania. Ta zasada jest znana jako Reguła Madelunga i jest to reguła empiryczna, której nie można wyjaśnić za pomocą mechaniki kwantowej.
Sekwencja wypełniania jest prosta dla pierwszych trzech rzędów układu okresowego, ale w czwarty rząd, w którym znajdują się elementy przejściowe, kolejność napełniania przechodzi serię series zmiany. W sumie jest 20 anomalnych przedmiotów, które nie stosują się do tej zasady.
Ewolucja stołu trwa do dziś
W 2006 roku chemik teoretyczny Eugen Schawrz Udało mu się wyjaśnić anomalie reguły Madelunga, biorąc pod uwagę, że atomy mogą mieć różne konfiguracje elektronowe w zależności od poziomu energii. Obliczając średnie, konfiguracje elektronowe większości pierwiastków są zgodne z regułą Madelunga.
Układ okresowy pierwiastków pozostaje przedmiotem dyskusji w XXI wieku, chociaż układ lub konfiguracja elektroniczna elementów, nadal ważne jest wyjaśnienie tego uporządkowania i anomalii obserwowanych w konfiguracjach elektronicznych za pomocą a teoria.
Jeśli chcesz przeczytać więcej artykułów podobnych do Ewolucja układu okresowego – podsumowanie, zalecamy wpisanie naszej kategorii Atom.
Bibliografia
Różni autorzy. (2019)Specjalne: układ okresowy pierwiastków. Badania i nauka. Barcelona: Scientific Press S.A.



