10 rodzajów pierwiastków chemicznych (wyjaśnione i sklasyfikowane)
Ile pierwiastków chemicznych musi istnieć we wszechświecie? To pytanie ma jeszcze długą drogę do przebycia, ponieważ naukowcy od czasu do czasu tworzą własne sztuczne pierwiastki chemiczne.
Możemy jednak odpowiedzieć: ile rodzajów pierwiastków chemicznych musi istnieć, coś, o czym dowiemy się dalej.
- Powiązany artykuł: „11 rodzajów reakcji chemicznych”
Rodzaje pierwiastków chemicznych
W naturze możemy znaleźć wszelkiego rodzaju substancje. Substancje te zwykle nie znajdują się w stanie czystym, ale są wynikiem połączenia różnych elementy lub materiały, które poprzez różne reakcje, procesy i okresy czasu dały początek wszelkiego rodzaju materiał. Nie ma we wszechświecie niczego, co nie jest wynikiem połączenia atomów należących do różnych typów pierwiastków chemicznych, co zobaczymy dogłębnie.
Jednak zanim przyjrzymy się rodzajom pierwiastków chemicznych, zróbmy mały przegląd nauk ścisłych w szkole średniej i pamiętajmy, czym są pierwiastki chemiczne.
Nazywamy „pierwiastek chemiczny” materią, która składa się z tego samego typu atomu, to znaczy substancji, która jest atomowo czysta.
Pierwiastki chemiczne nie dają się rozłożyć na prostsze i są klasyfikowane w układzie okresowym pierwiastków jako czystych materiałów wszechświata.Ale strzeż się! Nie wolno mylić pierwiastków z prostymi substancjami, ponieważ w niektórych przypadkach mogą się składać dwa lub więcej atomów tego samego pierwiastka cząsteczki pogrupowane na różne sposoby, które powodują, że niektóre właściwości fizyczne danego pierwiastka różnią się, przy czym te przypadki są izotopy. Na przykład diament i węgiel to substancje wykonane z pierwiastka chemicznego węgla (C). ale to jest zorganizowane na różne sposoby i daje dwa zupełnie różne materiały.
Carl Sagan Powiedział, że jesteśmy gwiezdnym pyłem odbijającym się od gwiazd. To piękne zdanie nie jest zwykłą metaforą, ale faktem naukowym. Pierwiastki chemiczne powstają, o ile nam wiadomo, wewnątrz gwiazd w wyniku kompleksu procesy syntezy jądrowej i rozszczepienia atomowego, które generują coraz cięższe pierwiastki, w wyniku procesu zwanego nukleosynteza.
Większość znanych pierwiastków można pozyskać z natury, znaleziony spontanicznie lub tworzący związki z innymi pierwiastkami, takimi jak uran (U), węgiel (C), krzem (Si), srebro (Ag) czy złoto (Au). Z drugiej strony inne zostały wyprodukowane w laboratoriach, takich jak ameryk (Am), berkel (Bk) lub curium (Cm). Niezależnie od metody jego otrzymywania lub tego, czy występuje w naturze, w zależności od swoich właściwości, dany pierwiastek chemiczny będzie miał pewne zastosowania lub inne.
Obecnie znanych jest około 118 pierwiastków chemicznych, chociaż biorąc pod uwagę, że ludzie potrafili wyprodukować nowe pierwiastki, rozszerzenie układu okresowego jest kwestią czasu.
- Możesz być zainteresowany: „Dwa rodzaje elektryczności (wyjaśnione)”
Główne rodzaje pierwiastków chemicznych
Główne typy pierwiastków chemicznych są reprezentowane w układzie okresowym, układ klasyfikacja stworzona przez rosyjskiego chemika Dymitra Mendelejewa (1834-1907), który położył jej podwaliny w 1869. Pierwiastki chemiczne są uporządkowane wizualnie na podstawie ich właściwości i cech.
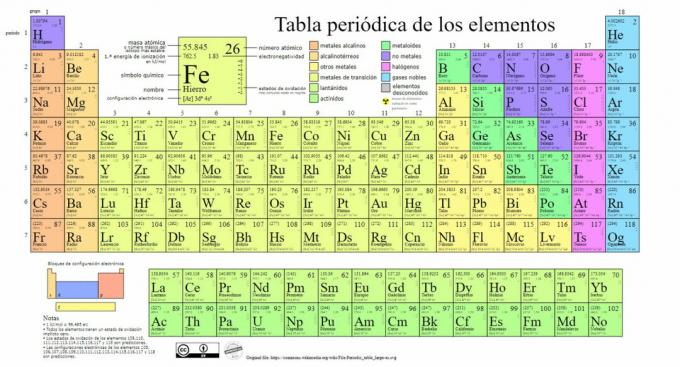
Z biegiem czasu i w miarę jak chemia dokonywała ważnych odkryć naukowych, tabela ta byłaby sukcesywnie rozszerzana, osiągając dzisiejszą formę ze znanymi do tej pory 118 elementami.
Obecnie w tej tabeli możemy znaleźć następujące rodzaje pierwiastków chemicznych:
1. Metale
Metale są pierwiastki chemiczne, które zazwyczaj zawierają od jednego do trzech elektronów na ostatniej orbicie ich atomu, elektronów, które można łatwo przenosić czyniąc je przewodnikami ciepła i elektryczności.
Metale są zwykle plastyczne i ciągliwe, z charakterystycznym połyskiem, którego intensywność zależy od ruchu elektronów tworzących ich atomy. W większości przypadków metale są stałe w temperaturze pokojowej, z wyjątkiem rtęci.
Wśród metali znajdujemy złoto (Au), srebro (Ag), miedź (Cu) i aluminium (Al), których właściwości fizyczne czynią je wspaniałymi przewodnikami elektryczności, choć ich obecność w przyrodzie jest bardzo zróżnicowana, co znajduje odzwierciedlenie w różnicy między ich wagami.
Uważa się, że 75% pierwiastków chemicznych występujących w przyrodzie to metale, a pozostałe 25% stanowiłyby gazy szlachetne, metaloidy i inne typy.
W tej kategorii znajdują się klasyfikacje, odnajdujące aktynowce, lantanowce, metale przejściowe, metale alkaliczne, metale ziem alkalicznych i inne metale.
- Powiązany artykuł: „10 pokarmów bogatych w cynk”
1.1. Lantanowce
Pierwiastki lantanowców znajdują się w złożach złożonych z wielu minerałów. Są to białe metale, które łatwo utleniają się w kontakcie z powietrzem. Wśród nich znajdziemy lantan (La), promet (Pm), europ (Eu) i iterb (Yb).

- Możesz być zainteresowany: „Pięć rodzajów wiązań chemicznych: tak składa się materia”
1.2. aktynowce
Wszystkie izotopy aktynowców są radioaktywne. Wśród nich znajdziemy aktyn (Ac), uran (U), pluton (Pu) i einstein (Es).
1.3. Metale przejściowe
Metale przejściowe znajdują się w centralnej części układu okresowego. Jego główną cechą jest to, że mają elektronową konfigurację orbitalu „d” częściowo wypełnionego elektronami;.
W tej grupie znajdują się substancje wszelkiego rodzaju i według jej najszerszej klasyfikacji odpowiadałoby to pierwiastkom chemicznym od 21 do 30, od 39 do 48, od 71 do 80 i od 103 do 112, w sumie czterdzieści, a wśród nich znajdziemy wanad (V), ruten (Ru), srebro (Ag), tantal (Ta) i lawrencio (Lr).

1.4. Metale alkaliczne
Metale alkaliczne to grupa sześciu pierwiastków składających się z litu (Li), sodu (Na), potasu (K), rubidu (Rb), cezu (Cs) i francu (Fr). Są błyszczącymi, miękkimi metalami, bardzo reaktywnymi w normalnej temperaturze i ciśnieniu i łatwo tracą swój zewnętrzny elektron, znajdujący się na ich orbicie „s”.
1.5. Ziemie alkaliczne
Metale ziem alkalicznych to grupa pierwiastków, w której znajdziemy beryl (Be), magnez (Mg), wapń (Ca), stront (Sr), bar (Ba) i rad (Ra). Jego nazwa pochodzi od nazwy nadanej jej tlenkom, „ziem”, które mają właściwości zasadowe lub zasadowe.
Ziemie alkaliczne są twardsze niż alkaliczne, błyszczą i są dobrymi przewodnikami elektrycznymi. Są mniej reaktywne niż alkaliczne i działają jako dobre reduktory. Mają zdolność tworzenia związków jonowych i wszystkie mają dwa elektrony w swojej zewnętrznej powłoce.

1.6. Inne metale
Kategoria „inne metale” to rodzaj substancji, które znajdują się tutaj, ponieważ tak naprawdę nie wiesz, gdzie je umieścić.
Są to pierwiastki metaliczne znajdujące się w układzie okresowym wraz z niemetalami, w obrębie bloku p. Są miękkie i mają niską temperaturę topnienia. Wśród nich są między innymi glin (Al), ind (In), cyna (Sn) i bizmut (Bi).

2. Brak metali
Niemetale zazwyczaj posiadają na swojej ostatniej orbicie od pięciu do siedmiu elektronów, co sprawia, że że zyskują elektrony zamiast je oddawać, a zatem udaje im się mieć osiem elektronów, które w ten sposób je stabilizują jako atomy.
Te elementy są bardzo słabymi przewodnikami ciepła i elektryczności. Do tego nie mają charakterystycznego połysku, są mało plastyczne, mało ciągliwe i bardzo kruche w stanie stałym. Nie można ich zwijać ani rozciągać, w przeciwieństwie do metali.
Są one w większości niezbędne dla systemów biologicznych, ponieważ są obecne w związki organiczne, takie jak siarka (S), węgiel (C), tlen (O), wodór (H) i jod (I).

- Powiązany artykuł: „20 rodzajów kamieni szlachetnych (opisane i ze zdjęciami)”
3. Metaloidy
Jak sama nazwa wskazuje, metaloidy są pośrednia klasyfikacja między metalami i niemetalami, które mają właściwości obu grup. Wynika to z faktu, że na swojej ostatniej orbicie mają cztery atomy, co stanowi ilość pośrednią w stosunku do metali i niemetali.
Te pierwiastki chemiczne przewodzą prąd tylko w jednym kierunku, co nie pozwala na wykonanie tego w przeciwnym kierunku, jak to ma miejsce w metalach. Przykładem tego jest krzem (Si), metaloid wykorzystywany do produkcji elementów półprzewodnikowych dla przemysłu elektronicznego dzięki tej właściwości.
Inne metaloidy to: bor (B), arsen (As), antymon (Sb) i polon (Po).

4. Halogeny
Halogeny to grupa sześciu pierwiastków, które mają tendencję do tworzenia cząsteczek złożonych z dwóch atomów (dwuatomowych), które są bardzo aktywne chemicznie ze względu na ich elektroujemność.
Substancje te występują zwykle w postaci jonów, czyli naładowanych elektrycznie cząsteczek, które w tym przypadku są jednoujemne, silnie utleniające. Oznacza to, że halogeny są substancjami żrącymi i żrącymi.
Halogenami są: fluor (F), chlor (Cl), brom (Br), jod (I), astat (At) i tenes (Ts).

5. Gazy szlachetne
Gazy szlachetne to grupa siedmiu, których stan naturalny jest gazowy. Występują zwykle w postaci cząsteczek dwuatomowych o bardzo niskiej reaktywności, czyli nie wchodzą w reakcje z innymi pierwiastkami wchodzącymi w skład innych substancji iz tego samego powodu są one znane jako gazy obojętne. Dzieje się tak, ponieważ na jego ostatniej orbicie znajduje się maksymalna możliwa liczba elektronów dla tego poziomu, łącznie osiem.
Ta wyselekcjonowana grupa pierwiastków składa się z helu (He), neonu (Ne), argonu (Ar), kryptonu (Kr), ksenonu (Xe), radonu (Rn) i oganesonu (Og), znanego dawniej jako ununoctium.

