Como obter o NÚMERO DE MASSA?

Os átomos são parte de toda a matéria que constitui o universo. A matéria é muito variada, pois é composta por diferentes tipos de átomos, com diferentes características e propriedades. As características dos diferentes átomos são dadas pelas partículas que os formam: prótons, elétrons e nêutrons. As diferentes proporções entre um e outro são definidas em química com nomes diferentes (número de massa, número atômico, etc.). O número de massa nos dá o número final ou total de partículas no núcleo, ou o que é o mesmo, é fazem a soma entre prótons e nêutrons, e é usado na química para diferenciar os isótopos de um elemento químico.
Nesta lição de um PROFESSOR, veremos o número de massa, como obtê-lo, o que exatamente é e para que é usado.
Índice
- Qual é o número de massa?
- O número de massa e isótopos
- Como calcular o número de massa? - Fórmula
Qual é o número de massa?
O Número de massa não é nada mais do que o soma de prótons e nêutrons, ou seja, todas as partículas que estão no núcleo (lembre-se de que os elétrons orbitam ao redor do núcleo, formando a crosta).
O número de massa é escrito com o letra a e é indicado em uma situação sobrescrita, sempre à esquerda do símbolo que indica o elemento com o qual estamos lidando, é ou seja, o encontraremos como um pequeno número colocado à esquerda do símbolo do elemento, no topo do esta. Representa a massa do átomo medida em u.m.a (unidade de massa atômica) porque a massa dos elétrons é muito pequena, é tão pequena que pode ser ignorada ou negligenciada.
O número de massa dos átomos normalmente é usado para diferenciar isótopos de um elemento químico.

Imagem: Slideshare
O número de massa e isótopos.
Isótopos são variantes do mesmo elemento químico que têm diferentes quantidades de nêutrons, então diferem no número de massa. Os isótopos podem ocorrer normalmente na natureza (isótopos naturais) ou ser inteiramente feitos pelo homem (isótopos artificiais). Exemplos de isótopos na natureza são os de carbono:
O carbono ocorre como uma mistura de três isótopos com números de massa 12, 13 e 14: 12C, 13C e 14C.
Os isótopos têm inúmeras aplicações: são usados para tratamentos de câncer, determinando o aparecimento de venenos em tecidos como arsênico, marcadores de reações químicas, etc.
Cada um dos isótopos de um elemento químico pode ter características diferentes. Uma das características mais conhecidas e utilizadas é a meia-vida constante da meia-vida ou meia vida. A meia-vida de um isótopo é o tempo necessário para que metade dos núcleos de uma amostra inicial de um radioisótopo se desintegre. Na prática, os isótopos tendem a se desintegrar, mudando de formas menos estáveis para formas mais estáveis. estável, então isso também pode ser entendido como o tempo que leva para transmutar ou transformar o metade de os átomos radioativo de uma amostra. A meia-vida do carbono-14, que se torna carbono-12, é muito longa e é usada para datar antigos vestígios orgânicos, como os fósseis. Em contraste, a meia-vida de outros isótopos como o oxigênio-15 é de apenas alguns segundos (122 segundos, para ser exato).
No caso do hidrogênio, é isótopos naturais eles têm características e propriedades muito diferentes, por isso têm três nomes diferentes: hidrogênio convencional ou prótio 1H, deutério 2H (D) e trítio 3H (T). O hidrogênio tem outro isótopos artificiais (hidrogênio-4, hidrogênio-5, etc.).

Imagem: Slideshare
Como calcular o número de massa? - Fórmula.
A fim de calcular o número de massa de um átomo ou íon teremos que somar o número atômico (número de prótons em um átomo ou íon, normalmente representado como "Z") e o número de elétrons.
Número de massa (A) = número atômico (Z) + número de nêutrons (N)
PARA = Z + N
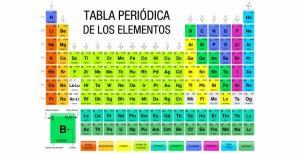
O número atômico pode ser encontrado na tabela periódica dos elementos, no canto superior esquerdo de cada um dos elementos. Além disso, o número de massa ou massa atômica aparecerá abaixo do elemento na tabela periódica.
Portanto, subtraindo o número atômico do número de massa, também podemos saber o número de prótons.
Número de nêutrons (N) = número de massa (A) - número atômico (Z)
N = A - Z
Por exemplo, se você consultar uma tabela periódica, verá que o ferro tem um número de massa de 55,84, ou seja, A = 56 arredondado para a unidade mais próxima; Seu número atômico (Z) é 26, então seu número de nêutrons será:
N = A - Z = 56-26 = 30
Se você quiser ler mais artigos semelhantes a Como obter o número de massa?, recomendamos que você insira nossa categoria de O átomo.