PRINCIPAIS CARACTERÍSTICAS dos ISOTOPES

Imagem: Planetas
Toda a matéria que constitui nosso planeta é composta de átomos. Mas todos os átomos não são iguais, átomos de elementos diferentes têm números diferentes de prótons, nêutrons e elétrons. Às vezes, o número destes partículas subatômicas não são as mesmas, não são equilibrados, e espécies como isótopos. Isótopos são átomos do mesmo elemento (por exemplo, hidrogênio), mas que não têm o mesmo número de nêutrons. Este "desequilíbrio" causa o características dos isótopos do mesmo elemento não são iguais. Nesta lição de um PROFESSOR, examinaremos todos esses recursos em detalhes. Nós começamos!
Índice
- O que é um isótopo?
- Características atômicas de isótopos
- Uma curiosa aplicação de isótopos: marcação isotópica
- Características dos isótopos do mesmo elemento
O que é um isótopo?
Antes de falar sobre as características dos isótopos, é importante entender melhor em que consiste. partícula subatômica. Poderíamos dizer quais são os isótopos são "subgrupos" de átomos: Eles são átomos do mesmo elemento, mas que diferem em certas coisas.
Isótopos são dois átomos com o mesmo número de prótons (o mesmo número atômico), mas número diferente de nêutrons (massa atômica diferente). Os isótopos do mesmo elemento são geralmente nomeados com o nome do elemento seguido de sua massa atômica. É bem conhecido el carbono quatorze (C14), que é usado para determinar a idade dos fósseis, mas o carbono tem outros isótopos, como carbono 12 e carbono 13, que são mais estáveis do que outros isótopos de carbono, como carbono 8 ou carbono carbono 22.
Em nosso caso, todos esses átomos são átomos de carbono, então eles têm um número atômico de 6 (Z = 6), mas carbono 12 (Carbono "normal") tem um peso atômico de 12 versus o peso atômico de 14 do carbono 14 ou o peso atômico de 8 do carbono C8.
Essas diferenças entre os diferentes isótopos podem fazer com que os átomos tenham características diferentes, comportamentos com átomos de outros elementos, meias-vidas, etc.
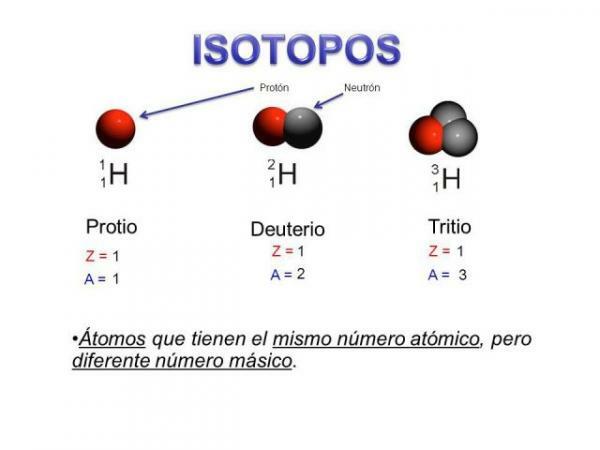
Imagem: Suas Tarefas
Características atômicas dos isótopos.
- A primeira característica dos isótopos em nível atômico é que todos os isótopos são átomos do mesmo elemento.
- Esta característica principal nos leva a uma segunda característica: todos os isótopos do mesmo elemento têm o mesmo número atômico, ou seja, o mesmo número de prótons.
- Todos os isótopos de um elemento têm o mesmo número de prótons.
- Os isótopos de um mesmo elemento possuem diferentes números de nêutrons, ou seja, número de massa diferente ou massa atômica.

Imagem: EHU
Uma curiosa aplicação dos isótopos: marcação isotópica.
A marcação isotópica é uma técnica que usa duas características muito importantes dos isótopos: que todos os isótopos reagem da mesma maneira em reações químicas e que alguns deles têm radioatividade.
Durante uma reação química, duas ou mais substâncias, chamados reagentes, eles combinam seus átomos para formar outras substâncias diferentes resultantes de combinações diferentes, os chamados produtos. O marcação isotópica é uma técnica pela qual podemos introduzir o isótopo radioativo de um reagente na reação, de modo que Este reagirá de forma normal e podemos localizá-lo a qualquer momento graças à radioatividade que emitir.
Outras variantes desta técnica nos permitem identificar diferentes isótopos de um reagente por espectrometria de massa ou espectroscopia infravermelha.

Imagem: Slideplayer
Características dos isótopos do mesmo elemento.
Como consequência das características atômicas vistas na seção anterior, os isótopos de um mesmo elemento podem ter outros tipos de características, que descreveremos a seguir.
- Isótopos do mesmo elemento têm massa diferente. Propriedades físicas como densidade, que será diferente para os diferentes isótopos do mesmo elemento.
- Certo propriedades quimicas eles dependem do tipo de elemento que é e, portanto, não serão diferentes para os diferentes isótopos de um elemento. Um exemplo é o solubilidade, o que vai ser constante para todos os isótopos de um elemento.
- Intimamente relacionada à sua igualdade em propriedades químicas está a seguinte característica dos isótopos: isótopos do mesmo elemento reagem da mesma maneira em reações químicas. Isso significa que se o átomo de carbono 12 (o átomo mais comum ou "normal") reage com dois átomos de oxigênio Para formar a molécula de dióxido de carbono, sabemos que os dos outros isótopos de carbono também são elas vão. Esta é uma propriedade muito importante para muitas aplicações práticas de isótopos e radioisótopos.
- Os isótopos de um elemento podem ser de origem natural ou artificial. Se o isótopo em questão pode ser encontrado na natureza, sem que a mão do homem tenha intervindo em sua criação, estamos diante de um isótopo natural ao passo que se foi criado em reatores nucleares, aceleradores de partículas ou geradores de radioisótopos, dizemos que é artificial. o mesmo elemento pode ter isótopos naturais e artificiais.
- Isótopos podem ser radioativo ou não radioativo. Isótopos radioativos são aqueles em que há excesso de energia, que o átomo tende a eliminar para ir de um estado instável a outro de maior estabilidade.
- Relacionado às características anteriores, podemos dizer que os isótopos radioativo tem um tempo de vida variável. O tempo de vida é o tempo que leva para o isótopo se desintegrar, ou seja, parar de ter aquele excesso de energia que o torna instável. Existem isótopos radioativos que são muito instáveis e têm uma vida útil de segundos, enquanto outros levam horas ou mesmo anos para se desintegrar e se tornarem isótopos mais estáveis. Os átomos normalmente criados artificialmente têm uma vida útil ou tempo de decomposição muito mais curta do que os naturais.
Se você quiser ler mais artigos semelhantes a Características dos isótopos, recomendamos que você insira nossa categoria de O átomo.
Bibliografia
- Briceño V, G. (s.f) Isótopos.
- Belmonte, A. (15 de maio de 2019). Propriedades do átomo.
- Wikipedia (22 de outubro de 2019). Isótopo.