Os 10 tipos de elementos químicos (explicados e classificados)
Quantos elementos químicos devem existir no universo? Essa questão ainda tem um longo caminho a percorrer, já que os cientistas estão criando seus próprios elementos químicos artificiais de tempos em tempos.
No entanto, o que podemos responder é quantos tipos de elementos químicos devem existir, algo que descobriremos a seguir.
- Artigo relacionado: "Os 11 tipos de reações químicas"
Os tipos de elementos químicos
Na natureza, podemos encontrar todos os tipos de substâncias. Essas substâncias geralmente não são encontradas em seu estado puro, mas são o resultado da combinação de diferentes elementos ou materiais que através de diferentes reações, processos e períodos de tempo deram origem a todos os tipos de matéria. Não há nada no universo que não seja o resultado da combinação de átomos pertencentes a diferentes tipos de elementos químicos, que veremos em profundidade.
No entanto, antes de examinar os tipos de elementos químicos, vamos fazer uma pequena revisão das ciências do ensino médio e lembrar o que são os elementos químicos.
Chamamos "elemento químico" de matéria composta do mesmo tipo de átomo, ou seja, uma substância atomicamente pura. Os elementos químicos não podem ser decompostos em mais simples e são classificados na tabela periódica dos elementos como materiais puros do universo.
Mas cuidado! Não devemos confundir elementos com substâncias simples, pois em certos casos dois ou mais átomos do mesmo elemento podem compor. moléculas agrupadas de maneiras diferentes que fazem com que algumas das propriedades físicas do elemento em questão variem, sendo esses casos o isótopos. Por exemplo, diamante e carbono são substâncias feitas do elemento químico carbono (C). mas isso é organizado de maneiras diferentes e resulta em dois materiais completamente diferentes.
Carl sagan Ele disse que somos poeira estelar refletindo nas estrelas. Esta bela frase não é uma mera metáfora, mas um fato científico. Os elementos químicos são formados, tanto quanto sabemos, no interior das estrelas, sendo o resultado de complexos processos de fusão e fissão atômica que geram elementos cada vez mais pesados, resultado de um processo denominado nucleossíntese.
A maioria dos elementos conhecidos pode ser obtida da natureza, encontrada espontaneamente ou formando compostos com outros elementos como urânio (U), carbono (C), silício (Si), prata (Ag) ou ouro (Au). Outros, por outro lado, foram fabricados em laboratórios como o amerício (Am), o berquélio (Bk) ou o cúrio (Cm). Qualquer que seja o método de obtenção ou se está presente na natureza, dependendo de suas propriedades, o elemento químico em questão terá alguns usos ou outros.
Atualmente, são conhecidos cerca de 118 elementos químicos, embora levando em consideração que os humanos têm sido capazes de fabricar novos elementos, é uma questão de tempo até que a tabela periódica se expanda.
- Você pode estar interessado: "Os 2 tipos de eletricidade (explicado)"
Os principais tipos de elementos químicos
Os principais tipos de elementos químicos estão representados na tabela periódica, um sistema de classificação criada pelo químico russo Dmitri Mendeleev (1834-1907) que lançou suas bases em 1869. Os elementos químicos são ordenados visualmente com base em suas propriedades e características.
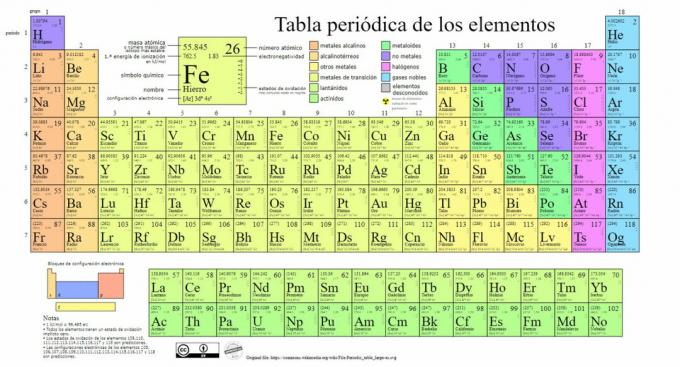
Com o tempo e à medida que a química fazia descobertas científicas importantes, esta tabela seria expandida consecutivamente, alcançando a forma que tem hoje com os 118 elementos conhecidos até agora.
Atualmente, nesta tabela podemos encontrar os seguintes tipos de elementos químicos:
1. Metais
Metais são elementos químicos que geralmente contêm entre um e três elétrons na última órbita de seu átomo, elétrons que podem ser facilmente transferidos tornando-os condutores de calor e eletricidade.
Os metais costumam ser maleáveis e dúcteis, com brilho característico cuja intensidade depende do movimento dos elétrons que constituem seus átomos. Na maioria das vezes, os metais são sólidos à temperatura ambiente, exceto o mercúrio.
Entre os metais encontramos ouro (Au), prata (Ag), cobre (Cu) e alumínio (Al) cujas características físicas os tornam magníficos condutores de eletricidade., embora sua presença na natureza seja muito variada, refletida na diferença entre seus pesos.
Acredita-se que 75% dos elementos químicos existentes na natureza sejam metais, enquanto os 25% restantes seriam constituídos por gases nobres, metalóides e outros tipos.
Existem classificações dentro desta categoria, encontrando actinídeos, lantanídeos, metais de transição, metais alcalinos, metais alcalino-terrosos e outros metais.
- Artigo relacionado: "10 alimentos ricos em zinco"
1.1. Lantanídeos
Os elementos lantanídeos são encontrados em depósitos compostos de muitos minerais. São metais brancos que se oxidam facilmente quando em contato com o ar. Entre eles encontramos o lantânio (La), o promécio (Pm), o európio (Eu) e o itérbio (Yb).

- Você pode estar interessado: "Os 5 tipos de ligações químicas: é assim que a matéria é composta"
1.2. Actinides
Todos os isótopos de actinídeos são radioativos. Entre eles encontramos actínio (Ac), urânio (U), plutônio (Pu) e einstênio (Es).
1.3. Metais de transição
Os metais de transição estão localizados na parte central do sistema periódico. Sua principal característica é que tem configuração eletrônica do orbital "d" parcialmente preenchido com elétrons.
Nesse grupo existem substâncias de todos os tipos e, de acordo com sua classificação mais ampla, corresponderia a elementos químicos de 21 a 30, de 39 a 48, de 71 a 80 e de 103 a 112, sendo um total de quarenta e entre eles encontraríamos vanádio (V), rutênio (Ru), prata (Ag), tântalo (Ta) e lawrencio (Lr).

1.4. Metais alcalinos
Os metais alcalinos são um grupo de seis elementos compostos por lítio (Li), sódio (Na), potássio (K), rubídio (Rb), césio (Cs) e frâncio (Fr). Eles são metais macios e brilhantes, altamente reativos em temperatura e pressão normais e perdem facilmente seu elétron externo, localizado em seu orbital "s".
1,5. Alcalino-terrosos
Os metais alcalino-terrosos são um grupo de elementos nos quais encontramos berílio (Be), magnésio (Mg), cálcio (Ca), estrôncio (Sr), bário (Ba) e rádio (Ra). Seu nome vem do nome dado aos seus óxidos, "terrosos", que possuem propriedades básicas ou alcalinas.
Os alcalino-terrosos eles são mais duros do que alcalinos, brilham e são bons condutores elétricos. Eles são menos reativos do que os alcalinos e atuam como bons agentes redutores. Eles têm a capacidade de formar compostos iônicos e todos têm dois elétrons em sua camada mais externa.

1.6. Outros metais
A categoria "outros metais" é um tipo de substâncias que são encontradas aqui porque você realmente não sabe onde colocá-las.
São elementos metálicos localizados na tabela periódica junto com os metaloides, dentro do bloco p. Eles tendem a ser macios com baixos pontos de fusão. Entre eles estão o alumínio (Al), o índio (In), o estanho (Sn) e o bismuto (Bi), entre outros.

2. Sem metais
Os não metais geralmente possuem entre cinco e sete elétrons em sua última órbita, uma propriedade que torna que ganham elétrons em vez de abandoná-los e, assim, conseguem ter oito elétrons que assim os estabilizam como átomos.
Estes elementos eles são péssimos condutores de calor e eletricidade. Somado a isso, não possuem brilho característico, são pouco maleáveis, pouco dúcteis e muito frágeis no estado sólido. Eles não podem ser enrolados ou esticados, ao contrário dos metais.
Eles são principalmente essenciais para sistemas biológicos, uma vez que estão presentes em compostos orgânicos, tais como enxofre (S), carbono (C), oxigênio (O), hidrogênio (H) e iodo (I).

- Artigo relacionado: "Os 20 tipos de pedras preciosas (descritas e com fotos)"
3. Metalóides
Como o nome sugere, os metalóides são uma classificação intermediária entre metais e não metais que possuem propriedades de ambos os grupos. Isso se deve ao fato de eles possuírem quatro átomos em sua última órbita, quantidade intermediária à qual os metais e não metais possuem.
Esses elementos químicos conduzem eletricidade apenas em uma direção, não permitindo que isso seja feito na direção oposta, como acontece com os metais. Um exemplo disso é o silício (Si), metalóide utilizado na fabricação de elementos semicondutores para a indústria eletrônica graças a essa propriedade.
Outros metalóides são: boro (B), arsênio (As), antimônio (Sb) e polônio (Po).

4. Halogênios
Halogênios são um grupo de seis elementos que eles tendem a formar moléculas compostas por dois átomos (diatômicos) que são muito ativos quimicamente devido à sua eletronegatividade.
Essas substâncias geralmente aparecem na forma de íons, ou seja, moléculas eletricamente carregadas, que neste caso são mononegativas, altamente oxidantes. Isso significa que os halogênios são substâncias cáusticas e corrosivas.
Os halogênios são: flúor (F), cloro (Cl), bromo (Br), iodo (I), astato (At) e tenese (Ts).

5. gases nobres
Os gases nobres são um grupo de sete cujo estado natural é gasoso. Geralmente aparecem na forma de moléculas diatômicas de baixíssima reatividade, ou seja, não reagem com outros elementos que compõem outras substâncias. e, por esse mesmo motivo, são conhecidos como gases inertes. Isso porque em sua última órbita há o número máximo de elétrons possível para aquele nível, oito no total.
Este seleto grupo de elementos é composto de hélio (He), néon (Ne), argônio (Ar), criptônio (Kr), xenônio (Xe), radônio (Rn) e oganésio (Og), anteriormente conhecido como ununoctium.

