Evoluția TABELULUI PERIODIC: de la crearea sa până astăzi
Tabelul periodic este unul dintre cele mai iconice icoane a științei. Deși 2019 a fost cea de-a 150-a aniversare de la crearea sa, nu este în niciun caz un document finalizat. În această lecție de la un PROFESOR vom vedea ce este evoluția tabelului periodic de la crearea sa până în prezent și ce progrese în cunoașterea atomilor și a proprietăților lor au făcut-o posibilă.
Index
- Ce este tabelul periodic?
- Primul tabel periodic: originea
- Istoria tabelului periodic și evoluția
Ce este tabelul periodic?
tabelul periodic Sistemul periodic de elemente este documentul științific care concentrează mai multe informații în mai puțin spațiu și constituie una dintre cele mai puternice icoane ale științei. Conține o bună parte din cunoștințe pe care le avem despre chimie. Nu există un document similar în nicio altă disciplină științifică.
Tabelul periodic al elementelor este a sistem de clasificare a elementelor chimice A început acum mai bine de 200 de ani. Acest sistem de clasificare a crescut și s-a schimbat de-a lungul timpului, pe măsură ce știința a progresat și au fost descoperite altele noi.
elemente chimice. Cu toate acestea, diferitele modificări au fost încorporate păstrând structura sa fundamentală intactă.Tabelul periodic se numește astfel deoarece exprimă grafic felul în care repetă la intervale regulate anumite proprietăți chimice. Este un tip de reprezentare bidimensională sau, în reprezentările sale mai moderne, tridimensională.
În tabel periodic clasic (bidimensională) elementele chimice sunt dispuse în grupuri sau familii și sunt reprezentate în tabelul periodic curent în coloane verticale. Aranjarea ordonată a acestor grupuri în coloane dă naștere la o serie de rânduri, care se numesc puncte, în care elementele sunt ordonate în funcție de greutatea lor atomică. Tabelul periodic este format din șapte perioade care variază în lungime.

Primul tabel periodic: originea.
Înainte de Mendeleev, alți oameni de știință au dezvoltat sisteme de clasificare a elementelor chimice. Dar, spre deosebire de tabelul periodic al elementelor, acestea erau simple liste cu elementele cunoscute; în timp ce tabelul periodic are particularitatea că este un sistem de clasificare în două dimensiuni (rânduri și coloane) sau trei dimensiuni, în versiunile sale cele mai moderne, în care elementele chimice sunt dispuse succesiv straturi.
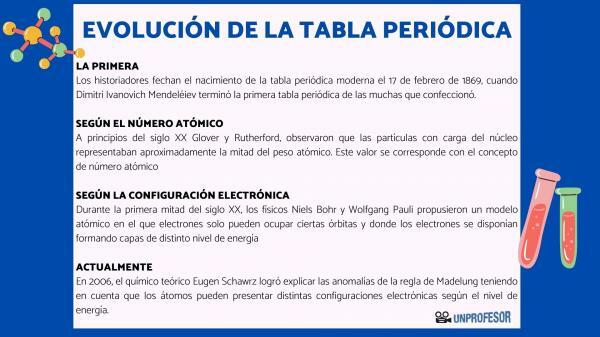
Din acest motiv, istoricii datează nașterea tabelului periodic modern 17 februarie 1869, cand Dimitri Ivanovici Mendeleev termina primul tabel periodic dintre multele pe care le-a făcut. Acest tabel consta din 63 de elemente dispuse în familii și a lăsat spații goale pentru elementele care nu erau încă descoperit, dar din care el dedusese greutatea lor atomică (ca în cazul galiului, germaniuului și Scandiu)
Datele cheie pentru descoperirea tabelului periodic au fost cunoștințele anterioare ale greutate atomica a fiecărui element.
Ce este greutatea atomică și numărul atomic?
Acest număr a reprezentat greutatea atomului și a fost singura valoare măsurabilă a atomi. Dar nu a fost în niciun caz măsurători directe (nu există dispozitive de măsurare care să permită cântărirea atomilor izolați), ci mai degrabă au fost un sistem care a stabilit un standard în care o valoare arbitrară de 1 a fost dată atomului de hidrogen și valoarea greutății atomice a elementelor rămase a fost calculată în raport cu acest Model.
Primele calcule ale numar atomic dintre elemente au fost realizate de chimistul englez John dalton, și a generat o mare dezbatere științifică în prima jumătate a secolului al XIX-lea. Cu toate acestea, în a doua jumătate a secolului al XIX-lea, exista deja un consens remarcabil cu privire la sistemul de calcul al greutăților atomice ale elementelor. Greutatea atomică a devenit începând cu Mendeleev, un criteriu cheie pentru ordonarea corectă a elementelor din tabelul periodic.
Când Mendeleev a ordonat elementele cunoscute conform lor creșterea greutății atomice, a observat apariția proprietăților recurente care au permis gruparea elementelor în grupuri sau familii de elemente care erau similare între ele. Cu toate acestea, în unele cazuri, ordonarea elementelor în funcție de greutatea lor atomică nu a răspuns la asemănările dintre elementele observate și Mendeleev s-a schimbat poziția a 17 elemente în dispunerea tabelului periodic în ciuda greutăților lor atomice, pentru a le putea grupa cu acele elemente cu care au prezentat analogii.
Aceste modificări au arătat clar că unele dintre greutățile atomice acceptate nu erau corecte și au fost recalculate. În ciuda corecțiilor în greutățile atomice, au existat încă elemente care trebuiau plasate în alte poziții decât cele indicate de greutățile lor atomice.

Imagine: BBC.com
Istoria tabelului periodic și evoluția.
În ciuda contribuției neîndoielnice a lui Mendeleev, tabelul periodic al elementelor nu este rezultatul muncii unui singur cercetător. Pe lângă Mendeleev, în a doua jumătate a secolului al XIX-lea și în secolul al XX-lea, mulți Chimiștii au continuat să investigheze cel mai bun mod de a organiza informații despre elementele chimice cunoscut. Cu atât mai mult având în vedere că în acest timp descoperirea elemente chimice noi sau substanțe simple, datorită spectrometriei (care studiază interacțiunile dintre atomi și radiația electromagnetică).
clasificarea elementelor în tabelul periodic s-a bazat inițial pe calculele incipiente ale greutăți atomice a elementelor și a analogiilor dezvăluite care permiteau gruparea elementelor în familii analoage. Chiar și așa, motivul apariției acestor proprietăți periodice nu a putut fi explicat. De-a lungul secolului al XX-lea, odată cu descoperirea structurii electronice, a fost înțeles motivul acestei periodicități în proprietățile elementelor.
Numărul atomic ca ordine de sortare
La începutul secolului XX Glover și Rutherford, a observat că particulele încărcate ale nucleului au reprezentat aproximativ jumătate din greutatea atomică. Această valoare corespunde conceptului de numar atomic care este definit ca numărul de protoni din nucleul atomic și care coincide cu numărul de electroni dintr-un atom neutru. Această nouă valoare a justificat schimbările de poziție ale anumitor elemente care au fost realizate până atunci. De exemplu schimbarea de poziție între Telur și Iod.
În 1913, Henry Moseley a confirmat ordonarea tabelului în funcție de numărul atomic prin spectrometrie cu raze X. Ordinea în funcție de numărul atomic este încă în vigoare astăzi.
În același timp, în secolul al XX-lea, noi elemente chimice au continuat să fie descoperite datorită mecanicii cuantice și dezvoltării tehnicii de bombardarea atomilor de către particule, din a doua jumătate a sec. Cu această nouă tehnică a fost posibil să creăm elemente artificiale care nu sunt prezente în natură.
Deși s-au făcut progrese în aranjarea corectă a elementelor în cadrul tabelului periodic, totuși motivul apariției recurente a anumitor proprietăți (proprietățile periodic). Dezvoltarea mecanica cuantică (ramura fizicii care studiază comportamentul luminii și al atomilor la scară microscopică) din 1920 a fost decisivă pentru a explica motivul acestor proprietăți.
Configurarea electronică ca explicație a proprietăților periodice
În prima jumătate a secolului XX, fizicienii Niels Bohr Da Wolfgang Pauli au propus un model atomic în care electronii pot ocupa numai anumite orbite și unde electronii sunt dispuși formând straturi de diferite niveluri de energie. Modul în care electronii sunt distribuiți pe orbitali în diferite cochilii sau niveluri de energie este cunoscut sub numele de configurație electronică.
Descoperirea aranjamentului electronilor în configurațiile electronice a fost fundamentală pentru înțelegerea periodicității proprietăților. periodic, deoarece s-a observat că aceste proprietăți erau strâns legate de configurația electronică cea mai exterioară a atomilor (stratul de Valencia).
Ordinea în care electronii umple orbitalele atomice a fost stabilită în 1930 de către fizicianul Erwin Madelung care a stabilit o regulă numerică pentru ordinea umplerii. Această regulă este cunoscută sub numele de Regula Madelung și este o regulă empirică care nu a putut fi explicată prin intermediul mecanicii cuantice.
Secvența de umplere este simplă pentru primele trei rânduri ale tabelului periodic, dar în al patrulea rând, unde sunt situate elementele de tranziție, ordinea de umplere suferă o serie de alterări. Există un total de 20 de elemente anormale care nu respectă această regulă.
Evoluția tabelului continuă astăzi
În 2006, chimistul teoretic Eugen Schawrz El a reușit să explice anomaliile regulii lui Madelung ținând cont că atomii pot avea configurații electronice diferite în funcție de nivelul de energie. Calculând mediile, configurațiile electronice ale majorității elementelor sunt conforme cu regula lui Madelung.
Tabelul periodic rămâne o problemă de dezbatere în secolul 21, deși aranjamentul sau configurația electronică a elementele, este încă valabil să se explice această ordonare și anomaliile observate în configurațiile electronice prin intermediul unui teorie.
Dacă doriți să citiți mai multe articole similare cu Evoluția tabelului periodic - rezumat, vă recomandăm să introduceți categoria noastră de Atomul.
Bibliografie
Diversi autori. (2019)Special: tabelul periodic. Cercetare și știință. Barcelona: Scientific Press S.A.



