Aflați unde sunt electronii într-un ATOM

Electronii sunt particule subatomice care se învârt în jurul nucleului atomic într-un nor de electroni numit cortexul electronic. În această lecție de la un PROFESOR vom vedea unde sunt electronii structurii atomice, precum și comportamentul electronilor în diferitele stări ale atomilor (starea de bază și de excitare), când se formează atomi ioni monatomici și când electronii nu sunt legați de un anumit atom.
Index
- Ce sunt electronii și unde se găsesc?
- De unde știi care sunt electronii de valență?
- Electronii unui atom: stare de bază și stare de excitație
- Câștig sau pierdere de electroni: Formarea ionică monatomică
- Electroni în mișcare: curent electric
Ce sunt electronii și unde se găsesc?
electroni stiu găsi înăuntru din atomicare sunt cele mai mici unități care alcătuiesc materia. Atomii sunt indivizibili, iar structura și compoziția lor determină caracteristicile materialelor.
Atomii sunt compuși din trei tipuri de particule subatomice:
- Protoni: sunt particule cu masă și sarcină pozitivă
- Neutroni: sunt particule cu masă și fără sarcină electrică
- Electroni: Sunt particule fără masă și încărcate negativ.
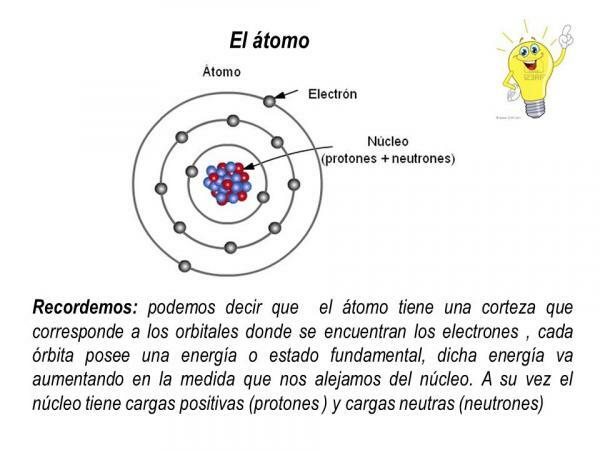
Protonii și neutronii fac parte din nucleul atomului, astfel încât nucleul atomic concentrează toată masa și sarcina pozitivă a atomului.
Pe de altă parte, electronii se învârt în jurul nucleului în orbite definite, formând un nor de electroni numit cortexul electronic. Învelișul electronic al atomului concentrează toată sarcina negativă și nu are masă.
Orbite de electroni
Orbitele descrise de electroni în jurul nucleului atomic sunt anumite orbite predefinite. Adică, căile electronilor din jurul nucleului atomic nu sunt aleatorii. În interiorul învelișului electronic există doar câteva orbite posibile pentru electroni; în timp ce alte orbite sunt interzise. este definit ca orbital atomic acea zonă din jurul nucleului în care probabilitatea de a găsi un electron este mai mare de 90%.
În fiecare dintre acești orbitali posibili, electronul care circulă prin el capătă o anumită energie care crește pe măsură ce orbitalii sunt mai departe de nucleu. Orbitalii sunt grupați în diferite nivelurile de energie (n) sau straturi, există un total de 7 niveluri de energie, n = 1 fiind cel mai mic nivel de energie și cel mai apropiat de nucleul atomului. În fiecare nivel sau nivel de energie există diferite tipuri de orbitali (orbitali s, p, d și f)
Aranjamentul în care electronii sunt distribuiți în diferitele niveluri de energie și orbitali ai unui atom este cunoscut sub numele de configurație electronică.
Imagine: Slideplayer
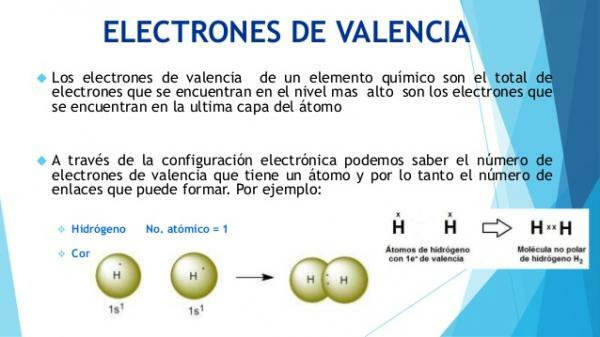
De unde știi care sunt electronii de valență?
Caracteristicile fizice și chimice ale atomilor sunt definite prin compoziția lor și, în special, prin configurația electronică a acestora strat exterior (stratul de valență).
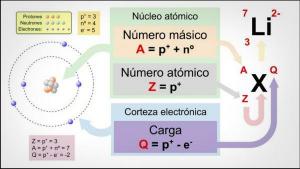
Elementele chimice sunt diferitele tipuri de atomi care există și sunt definite prin numărul lor atomic (Z) și numărul lor de masă (A).
- Număr atomic (Z): numărul de protoni ai unui element atomic, care este egal cu numărul de electroni dacă atomul este neutru.
- Număr de masă (A): numărul de particule cu masa unui element atomic, adică suma particulelor nucleului atomic (protoni plus neutroni).
Fiecărui element i se atribuie un simbol chimic care îl reprezintă și setul tuturor acestora este consemnat în documentul științific pe care ordonează în funcție de numărul lor atomic și le grupează în funcție de caracteristicile lor în familii și grupuri de afini: Tabelul periodic.
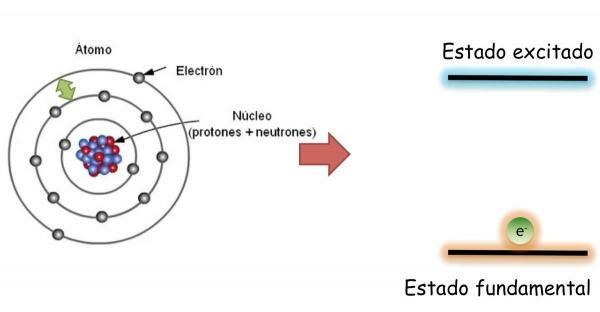
Electronii unui atom: stare de bază și stare de excitație.
În stare fundamentală, care este definit ca starea de energie minimă și stabilitate maximă a unui atom; electronii nu sunt distribuiți aleatoriu în diferiții orbitali atomici, ci ocupă diferiții orbitali într-un mod ordonat, completând întotdeauna în primul rând, cei mai mici orbitali fără energie.
În această stare, atomul are același număr de electroni ca protoni, iar sarcinile pozitive și negative se compensează reciproc, prin urmare atomul în ansamblu este neutru (nu are sarcină netă).
Cu toate acestea, electronii poate sări de la un orbital la altul emanând sau absorbind energie. Când electronii unui atom nu umple orbitalii în mod ordonat, se spune că atomul este înăuntru stare entuziasmată. În starea de excitație, unul sau mai mulți electroni ocupă orbitali de energie mai mare lăsând goi alții cu energie mai mică. În starea excitată atomii sunt extrem de instabili și tind să revină rapid la starea fundamentală.
La schimbarea orbitalului electronul emite sau absoarbe energie. Dacă electronul sare de pe o orbită cu energie inferioară la una cu energie mai mare, atomul va absorbi energia; în timp ce dacă saltul se face în direcția opusă (de la un orbital cu energie mai mare la una cu energie inferioară), atomul va elibera energie.
Pierderea sau câștigul de electroni: formarea ionilor monatomici.
Electronii din învelișul exterior al cortexului electronic (numit învelișul de valență) sunt electroni care pot părăsi atomul sau pot fi încorporați pentru aceasta. În acest fel, un atom poate câștiga sau pierde electroni.
Într-o atom neutru numărul de protoni prezenți în nucleu este egal cu cel al electronilor care alcătuiesc coaja sa electronică. Adică, numărul de sarcini pozitive este egal cu numărul de sarcini negative. Când există câștig sau pierdere de electroni, atomii se formează ioni monatomici.
Tipuri de ioni monatomici
În funcție de încărcarea ionului, se disting două tipuri:
- Cationi monatomici: atomi care au pierdut unul sau mai mulți electroni, astfel încât o parte din sarcina pozitivă a nucleului nu este compensată. Prin urmare, atomul capătă o sarcină pozitivă netă.
- Anioni monatomici: atomi care au câștigat unul sau mai mulți electroni, astfel încât numărul de electroni să fie mai mare decât numărul de protoni din nucleu, astfel încât atomul să capete o sarcină negativă netă.

Electroni în mișcare: curent electric.
Când electronii nu sunt legați de niciun atom în special, ele se deplasează prin spațiul liber dintre atomi. Această mișcare independentă a electronilor formează un flux de sarcină electrică care poate circula prin anumite materiale (materiale conductoare și semiconductoare).
De exemplu, acest lucru se întâmplă în cazul curent electric care furnizează energie clădirilor, vehiculelor etc.
Dacă doriți să citiți mai multe articole similare cu Unde se găsesc electronii?, vă recomandăm să introduceți categoria noastră de Atomul.
Bibliografie
Alejandrina Gallego Picó, Rosa Mª Garcinuño Martínez, Mª José Morcillo Ortega, Miguel Ángel Vázquez Segura. (2018) Chimie de bază. Madrid: Uned