Părți ale unui atom și caracteristicile lor
Imagine: Answers.tips
Atomii sunt elementele de bază care formează materia, fiind prezent în toate stările materiei. Sunt elemente foarte mici, imposibil de văzut prin ochiul uman, dar sunt cu adevărat importante pentru universul nostru. Pentru a înțelege mai bine cum sunt atomii și cum funcționează, în această lecție de la un PROFESOR despre care vom vorbi părți ale unui atom și caracteristicile acestora.
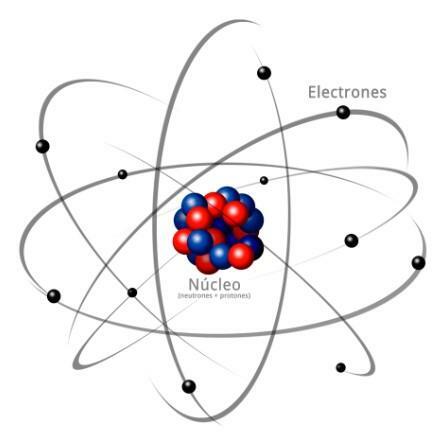
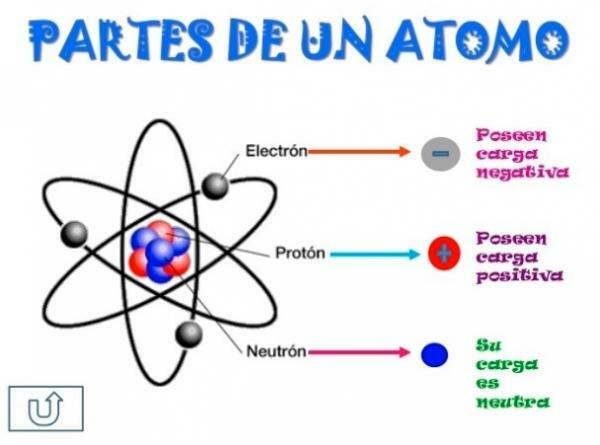
Toți atomii sunt compuși dintr-un miez și o crustă. Nucleul, așa cum indică numele său, este partea centrală a atomului, unde particulele a căror sarcină este pozitivă și care sunt numite protoni, și particulele a căror încărcare este neutră, adică nu au o sarcină electrică, primind numele de neutroni. Masa ambelor particule, atât protoni cât și neutroni, este similară. Toți atomii aceluiași element chimic au un număr egal de protoni, primind acest număr numele de număr atomic și folosind litera Z pentru a-l reprezenta.
Pe de altă parte, există Cortex ce este partea exterioară a atomului
. În scoarță găsim electroni, care sunt particule încărcate negativ. Electronii se rotesc cu mare viteză în jurul nucleului la diferite niveluri, fiind particule mult mai mici decât cele care se află în nucleu.Fiind neutroni neutri, protoni pozitivi și electroni negativi, atomul are o sarcină electrică neutră, întrucât au același număr de protoni ca electroni. Deși există cazuri în care electronii sunt în număr mai mic sau mai mare decât protoni, provocând încărcarea atomul este negativ sau pozitiv, în acest caz primește numele de ion, anion dacă este negativ sau cation dacă este pozitiv.
Imagine: Brainly
Pentru a continua cu această lecție despre părțile unui atom și caracteristicile lor, trebuie să vorbim despre evoluția pe care au avut-o părțile atomului, de când modelul atomic s-a schimbat în timp datorită studiilor oamenilor de știință. Trebuie luat în considerare faptul că mai multe dintre modelele pe care le vom explica sunt învechite, nefiind utilizate în prezent, dar sunt necesare pentru a înțelege evoluția comunității științifice pe acest subiect.
Evoluția istorică a modelului atomic se caracterizează prin în urma oamenilor de știință:
- Modelul Dalton: Primul model atomic a fost opera lui John Dalton în 1803. Este un model foarte primitiv căruia îi lipsesc multe elemente precum prezența electronilor și a protonilor.
- Modelul Thomson: John Thomson a reușit să realizeze un model atomic mai complet decât cel al lui Dalton, adăugând mai multe elemente cheie. Thomson a descoperit existența electronilor și a sarcinilor pozitive și negative.
- Modelul Nagaoka: Fizicianul japonez Nagaoka nu a fost de acord cu modelul lui Thomson, el credea că atomul trebuie să aibă un nucleu mare încărcat pozitiv pe care se rotesc electronii încărcați negativ. Teoria sa se numește saturniană, deoarece a comparat electronii cu inelele lui Saturn. De multe ori acest model nu este numit, dar este esențial să înțelegem marele pas făcut în acest moment.
- Modelul Rutherford: Modelul lui Rutherford s-a bazat pe existența unui nucleu încărcat pozitiv pe care se roteau electronii încărcați negativ. Acest model este foarte asemănător cu cel al Nagaoka, fiind de ani foarte apropiați, deși modelul japonez este mai vechi.
- Modelul Bohr: Bohr a crezut că electronii ar trebui separați la o distanță mare de nucleul stratificat și numărul acestor particule orbitale ar trebui să fie egal cu numărul atomic. Modelul său înțelege, de asemenea, că numărul de electroni variază în fiecare carcasă, cu mai puțini electroni în prima carcasă decât în ultima.
- Model Schrodinger: Schrodinger a rupt convingerea că electronii sunt particule minuscule care se învârt în jurul nucleului. Omul de știință austriac a susținut că electronii se mișcau prin intermediul unei funcții de undă, adică prin forma orbitală.
- Modelul Dirac: Dirac a modificat ideile lui Schrodinger pentru modelul său, folosind „ecuația Dirac” pentru a oferi o imagine mai corectă a formei orbitale a electronilor.



