Pentru ce este TABELUL PERIODIC?
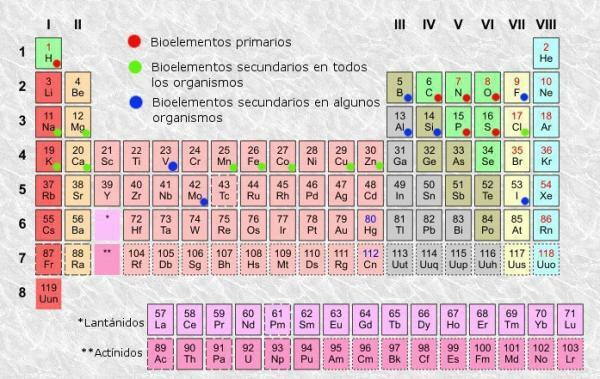
Tabelul periodic este un sistem de clasificare a elementelor atomice inventat în 1869 de chimistul rus Dmitri Mendeleev și ulterior reorganizat și actualizat de alți chimiști până la apariția sa actual. Deși este un instrument care s-a dovedit util de-a lungul istoriei (de aceea a continuat să fie folosit și actualizat), este un atât de plictisitor de învățat și de înțeles, motiv pentru care ne-am pus cu toții întrebarea „La ce servește masa? periodic? ".
Dacă vrei să știi pentru ce este tabelul periodic și de ce este important să-i înțelegem proprietățile, continuați să citiți această lecție de la un PROFESOR.
Index
- Clasificarea tabelului periodic
- Găsirea numelui sau simbolului unui element cu tabelul periodic
- Cunoașteți masa atomică a unui element
- Cunoașteți numărul atomic al unui element
- Preziceți raza atomică a unui element
- Comparați energia de ionizare a două elemente
- Găsirea electronegativității unui element chimic
- Comparați afinitatea electronică a două elemente
Clasificarea tabelului periodic.
Ca în orice tabel, în tabelul periodic dintre elemente putem distinge coloane (verticale) și rânduri (orizontale). În tabelul periodic sunt 18 coloane sau grupuri și 7 rânduri sau puncte.
În plus, veți fi în măsură să verificați dacă în mod normal, în fiecare dintre casetele din tabel, apar cel puțin următoarele informații:
- Simbolul elementului chimic: abrevieri sau semne care sunt folosite pentru identificarea elementelor. Ele constau de obicei din una sau două litere, dintre care prima este întotdeauna cu majuscule.
- Nume element chimic: denumirea elementului chimic care corespunde prescurtării superioare. De obicei se află sub simbol.
- Numar atomic: numărul total de protoni pe care îi are fiecare atom al acelui element. De obicei, apare în partea stângă sus a casetei de articole (sau în partea dreaptă sus a tabelelor mai complete).
- Masă atomică: masa unui atom poate fi considerată în mod normal ca masa totală de protoni și neutroni dintr-un singur atom. Este disponibil sub numele elementului în cele mai simple tabele, deși în altele poate apărea în partea dreaptă sus a casetei elementului.
Există tabele periodice care includ alte informații mai complexe și specifice, cum ar fi stări de oxidare (util la formularea compușilor chimici, de exemplu), energie de ionizare, electronegativitate etc., dar tabele periodice de bază, de obicei oferă suficiente informații și sunt de obicei suficiente pentru utilizatorul mediu, care din acesta poate afla informații precum cea pe care ți-o spunem mai jos.

Aflați numele sau simbolul unui element cu tabelul periodic.
Uneori știm simbolul elementului chimic dar nu-i știm numele. Alteori, știm denumirea elementului chimic, dar nu abrevierea sau simbolul acesteia. De fapt, este foarte ușor să ți se întâmple asta vreodată în clasă.
În aceste cazuri, putem folosi un tabel periodic, fără a fi necesar ca acesta să fie unul complex și să consultăm datele lipsă rapid și precis.
Cunoașteți masa atomică a unui element.
Uneori cunoaștem elementul chimic cu care avem de-a face, dar trebuie să îl cunoaștem masă atomică, adică cât de mult cântărește un atom din acel element.
Aceste informații vor fi utile, de exemplu, atunci când efectuați următoarele sarcini:
- Calculați cantitatea specifică a unei substanțe.
- Analizați rezultatele obținute în cadrul testelor sau experimentelor.
- Calculați procentul de masă.
- Înțelegeți masele molare precise ale moleculelor complexe.
Cunoașteți numărul atomic al unui element.
Numărul atomic este numărul total de protoni pe care îl are un atom al unui element. Într-un atom neutru electric, altul decât un cation (încărcat pozitiv, cu un electron mai mic decât starea sa normală) sau un anion (încărcat negativ, cu un electron mai mult decât starea sa normală), numărul de protoni este egal cu cel al electroni.
Numărul de protoni este factorul decisiv atunci când vine vorba de a distinge un element de altul, deoarece numărul de electroni sau neutroni nu modifică tipul de element.

Preziceți raza atomică a unui element.
Raza atomică este la jumătatea distanței dintre centrul a doi atomi ai aceluiași element care abia se ating unul de celălalt. În acest caz, cunoașteți poziția unui element chimic pe tabelul periodic Ne poate ajuta să aflăm raza sa atomică aproximativă sau în comparație cu un alt element. Pentru aceasta, trebuie să știm asta raza atomică:
- Crește pe măsură ce ne deplasăm de sus în jos în tabelul periodic.
- Coboară pe măsură ce ne deplasăm de la stânga la dreapta prin tabelul periodic.
În acest fel, calciul este mai mic decât rubidiul, dar mai mare decât fierul.
Află mai multe despre Care este raza atomică cu această altă lecție video de la un PROFESOR.
Comparați energia de ionizare a două elemente.
energie de ionizare este energia necesară pentru a îndepărta un electron din atomul unui element. În acest caz, dacă cunoaștem poziția a două elemente în tabelul periodic, putem ști care element va fi mai ușor să „îndepărtăm” un electron. Va trebui să ținem cont doar de faptul că:
- Energia de ionizare scade pe măsură ce se deplasează în sus și în jos în tabelul periodic.
- Energia de ionizare crește pe măsură ce vă deplasați de la stânga la dreapta tabelului periodic.
Între beriliu și oxigen, oxigenul are mai multă energie de ionizare. Dacă comparăm oxigenul și sulful, care se află în același grup, dar în perioada următoare, oxigenul are, de asemenea, o energie de ionizare mai mare, deoarece este mai mare pe tabelul periodic.
Găsiți electronegativitatea unui element chimic.
Electronegativitate este capacitatea unui atom de a atrage electroni. În practică, acest lucru se traduce prin capacitatea de a forma o legătură chimică. Pentru a ști dacă un element chimic va avea o capacitate mare de a forma o legătură chimică sau nu, trebuie doar să ținem cont de modelul care urmează în tabelul periodic, adică:
- Coboară pe măsură ce se mișcă în sus și în jos.
- Crește pe măsură ce vă deplasați de la stânga la dreapta.
Ca și în cazul precedent, oxigenul este mai electronegativ decât beriliul și sulful, deoarece este mai la dreapta decât primul și mai mare decât sulful.

Comparați afinitatea electronică a două elemente.
Afinitate electronică este el schimbarea energiei pe care o suferă un atom neutru atunci când atrage un electron să devină un ion negativ. În acest caz, afinitatea electronică nu variază la fel de exact ca în cazurile anterioare, deși putem spune că, în general, afinitatea electronică:
- Se ridică, în aceeași perioadă, de la stânga la dreapta.
- Urcați, în același grup, de jos în sus.
Dacă doriți să citiți mai multe articole similare cu Pentru ce este tabelul periodic?, vă recomandăm să introduceți categoria noastră de Atomul.
Referințe
Aveți vreo contribuție sau comentariu cu privire la utilizările tabelului periodic? Simțiți-vă liber să o lăsați în secțiunea noastră de comentarii! Ți-a plăcut acest articol? De asemenea, vă puteți lăsa ratingul mai jos!



